Выделение - льд
Cтраница 1
Выделение льда из водных растворов [73] объясняет как то давно известное мореплавателям явление, что льды океанов дают пресную воду, так и то, что при вымораживании соленой воды ( как при ее испарении) получается раствор более богатый содержанием соли, чем взятый. В холодных странах пользуются этим для сгущения морской воды, которую потом испаряют для извлечения соли. [1]
По мере выделения льда концентрация раствора повышается, а температура его замерзания соответственно понижается. Например, при температуре 272, 874 К гидрат окиси кальция превращается в эвтектическую смесь, в которой Са ( ОН) 2 находится в твердом состоянии. Аналогичное явление происходит при замораживании коллоидного раствора: коллоидные фракции оттесняются льдом в области, замерзающие позже. [2]
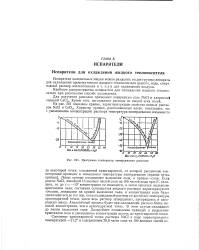 |
Диаграмма температур затвердевания рассолов. [3] |
Левые кривые показывают выделение льда, а правые-соли. Если рассол NaCl, имеющий 15 весовых частей соли на 100 частей воды при 0, охладить, то до t - - 10 концентрация не изменится, а затем начнется выделение кристаллов льда; состояния остающегося жидкого раствора характеризуются точками, лежащими на кривой выделения льда, и концентрация соли будет увеличиваться до тех пор, пока охлаждаемый раствор не достигнет температуры криогидратной точки, затем весь раствор затвердевает, превращаясь в однородную массу. [4]
Ветвь ОК отвечает условиям выделения льда в системе соль-вода. В области DEHF совместно существуют в твердой фазе лед и соль; жидкая фаза отсутствует. [5]
Левая кривая отражает изменение температуры выделения льда от прибавления азотнокислого серебра. Обе эти кривые сходятся в эвтектической точке; она соответствует самой низкой температуре, при которой еще может существовать жидкая фаза. В случае водных растворов солей эвтектическая точка называется криогидратной точкой. [6]
Это равновесие интересно при анализе возможности выделения льда в арктических газопроводах при недостаточной степени осушки газа. [7]
Ьго раствора КС1, пересекает кривую выделения льда, а весь хлористый калий останется в растворе. [8]
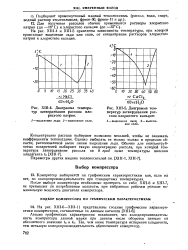 |
Диаграмма температур затвердевания рассола хлористого кальция. [9] |
На рис. XIII-4 и XIII-5 приведены зависимости температуры, при которой происходит выделение льда или соли, от концентрации растворов хлористого натрия и хлористого кальция. [10]
Если охлаждать раствор воды и NaCl то несколько ниже 0 С начнется выделение чистого льда ( без примеси соли) или выделение чистой твердой соли NaCl ( без примеси льда): вода и соль NaCl не образуют твердых растворов. То же самое происходит в жидком сплаве олова и цинка: при постепенном охлаждении начинает выкристаллизовываться или чистое олово, или чистый цинк, твердого же раствора цинк и олово не дают. [11]
При удалении части воды из растворов ( испарением при разных температурах или чрез выделение льда) должны получаться насыщенные растворы, а затем должно выделяться растворенное твердое вещество. Насыщенные при некоторой температуре растворы также должны выделять соответственную часть растворенного вещества, если чрез охлаждение [74] будут приведены к температуре, при которой вода не может удерживать бывшего количества вещества. Если это выделение, при охлаждении насыщенного раствора или при выпаривании, будет совершаться медленно, то во многих случаях образуются кристаллы растворенного тела; так обыкновенно и получают кристаллы растворимых солей и других веществ. Некоторые твердые тела выделяются из растворов весьма легко в форме отлично образованных кристаллов, могущих дойти до весьма большой величины. [12]
При образовании льда в разбавленном растворе увеличивается его концентрация и постепенно понижается температура выделения льда. При замерзании чистых растворов этот процесс завершается достижением эвтектической концентрации и температуры; эвтектический раствор затвердевает как единое целое, без отделения кристаллов растворителя. [13]
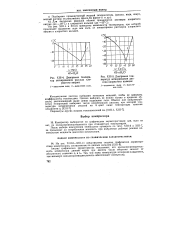 |
Диаграмма темпера.| Диаграмма тем. [14] |
На рис. XIII-4 и XII1 - 5 приведены зависимости температуры, при которой происходит выделение льда или соли, от концентрации растворов хлористого натрия и хлористого кальция. [15]
Страницы: 1 2 3 4