Выделение - перекись - водород
Cтраница 2
В данном сообщении приводятся некоторые результаты исследования вопросов, связанных с процессом выделения перекиси водорода из указанных смесей методом ректификации. [16]
Электролит, вытекающий из электролизеров - так называемый анолит, - подается в гидролизное отделение для выделения перекиси водорода. [17]
 |
Схема производства нефтехимической перекиси водорода. [18] |
Процесс заключается в восстановлении антрахинона до гидрохинона, обратном окислении до хинона с образованием перекиси водорода, выделении перекиси водорода и очистке раствора, возвращаемого в цикл. [19]
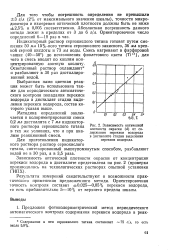 |
Зависимость оптической плотности окраски ( d от содержания перекиси водорода в дистилляте стадии выделения перекиси водорода. [20] |
Выбранная нами цветная реакция может быть использована также для периодического автоматического контроля попадания перекиси водорода в дистиллят стадии выделения перекиси водорода, состав которого указан выше. [21]
Медь и другие металлы, которые в небольших количествах оказывают значительное влияние на фотохимическую активность красителей всех классов, предохраняют от выделения перекиси водорода при облучении окрашенного хлопка во влажной атмосфере. Индантреновый оливково-зеленый В улучшает светопрочность Индантренового желтого GF и препятствует снижению прочности волокна под действием желтого красителя; другие синие и зеленые красители также оказывают защитное действие, но ни один не является столь эффективным, как Индантреновый оливково-зеленый В. [22]
При осаждении солей скандия, иттрия и лантана щелочами в присутствии HsO2 образуются осадки перекисных соединений состава Э ( ООН) ( OHb-JtHjO. Кислотами соединения эти разлагаются с выделением перекиси водорода. [23]
При осаждении солей скандия, иттрия и лантана щелочами в присутствии Н2О2 образуются осадки перекис ных соединений состава Э ( ООН) ( ОН) 2 HjO. Кислотами соединения эти разлагаются с выделением перекиси водорода. [24]
Дестилляция перекиси содорода из персульфата калии и серной кислоты протекает совершенно гладко, если персульфат смочить разбавленной серной кислотой так, чтобы лишь на поверхности кристаллической массы образовалась кашица, и затем пропускать над этой массой или через нее водяной пар. Этот способ является наиболее удачным решением проблемы выделения перекиси водорода и в таком виде применяется в промышленном масштабе. Так как в процессе образования перекиси водорода внешний обогрев жидкости отсутствует, то дсстилляцию можно производить Б керамиковой реторте. Перекись водорода, полученная по способу Питча и Адольфа, отличается исключительной чистотой, и растворы Н2О2 почти не содержат кислоты н твердого остатка. [25]
Озониды очень неустойчивы и могут разлагаться со взрывом. При обработке водой они обычно распадаются с выделением перекиси водорода и с образованием двух молекул кислородсодержащих соединений ( альдегидов или кетонов, стр. [26]
 |
Скорость мономолекулярного распада перекиси водорода ( 1 и органических гидроперекисей ( 2 при температуре 115. [27] |
Сравнение констант скорости распада, вычисленных по данным рис. 3 и представленных в таблице, приводит к выводу, что гидрооксиперекись, образующаяся при окислении изопро-пилового спирта, распадается на молекулярные продукты почти в 1 5 раза быстрее, чем перекись водорода. Указанные термодинамические и кинетические данные практически проявляются в том факте, что при выделении перекиси водорода из реакционных смесей ректификацией органические перекисные соединения, образовавшиеся при окислении изопропилового спирта наряду с перекисью водорода, при нагревании разлагаются на ацетон и перекись водорода почти полностью в то время, как разложение перекиси водорода практически отсутствует. Дальнейший ход кинетических кривых накопления перекиси водорода и органических перекисных соединений ( рис. 1 и 5) характеризуется появлением максимумов, после которых начинается расходование перекисных соединений с падением их концентрации и теоретического выхода. При этом опять распад органических перекисей несколько опережает распад перекиси водорода, что согласуется с положениями, высказанными выше о меньшей устойчивости гидроперекиси. [28]
 |
Скорость мономолекулярного распада перекиси водорода ( 1 и органических гидроперекисей ( 2 при температуре 115. [29] |
Сравнение констант скорости распада, вычисленных по данным рис. 3 и представленных в таблице, приводит к выводу, что гидрооксиперекись, образующаяся при окислении изопропилового спирта, распадается на молекулярные продукты почти в 1 5 раза быстрее, чем перекись водорода. Указанные термодинамические и кинетические данные практически проявляются в том факте, что при выделении перекиси водорода из реакционных смесей ректификацией органические перекисные соединения, образовавшиеся при окислении изопропилового спирта наряду с перекисью водорода, при нагревании разлагаются на ацетон и перекись водорода почти полностью в то время, как разложение перекиси водорода практически отсутствует. Дальнейший ход кинетических кривых накопления перекиси водорода и органических перекпсных соединений ( рис. 1 и 5) характеризуется появлением максимумов, после которых начинается расходование перекиспых соединений с падением их концентрации и теоретического выхода. При этом опять распад органических перекисей несколько опережает распад перекиси водорода, что согласуется с положениями, высказанными выше о меньшей устойчивости гидроперекиси. [30]
Страницы: 1 2 3