Электрохимическое выделение
Cтраница 1
Электрохимическое выделение при определении малых количеств элементов обычно комбинируется с каким-либо физико-химическим методом. Наиболее часто используется полярографический анализ. [1]
Электрохимическое выделение и растворение металлов происходят на отрицательных электродах аккумуляторов при их заряжении и разряде, а также на положительных электродах некоторых гальванических элементов и аккумуляторов, например на окиснортутном и окисносеребря-ном электродах. Процессы, аналогичные электроосаждению металлов - осаждение солей и окислов - происходят на положительных и отрицательных электродах многих химических источников тока. [2]
Электрохимическое выделение матрицы менее удобно и менее распространено, чем электровыделение микрокомпонентов. Методики, основанные на электровыделении матрицы, нехарактерны для сочетания электрохимического концентрирования с атомно-абсорбционным или эмиссионным определением, так как они требуют включения дополнительных операций по перенесению микрокомпонентов из раствора после электролиза на электрод, используемый в спектральном окончании. [3]
Электрохимическое выделение хрома связано главным образом с нанесением антикоррозионных покрытий. [4]
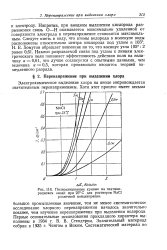 |
Поляризационные кривые на платино. [5] |
Электрохимическое выделение хлора на аноде сопровождается значительным перенапряжением. [6]
Электрохимическое выделение газов на аноде связано с поляризацией, причины которой установлены не во всех случаях. При выделении хлора на угольном электроде наблюдается поляризация, достигающая 0 1 в. Предполагают, что она связана с процессом адсорбции молекулярного хлора. Возможно, перенапряжение связано с замедленностью процесса образования молекул хлора из атомов. [7]
Электрохимическое выделение примесей из особо чистой воды без введения каких-либо добавок не может быть проведено из-за ее низкой электропроводности. В качестве добавок, повышающих электропроводность, опробованы различные кислоты ( соляная, азотная и серная) и некоторые их соли. [8]
Электрохимическое выделение брома из рассолов не является самостоятельным способом получения брома, а только стадией процесса, которая может применяться в сочетании с любым способом извлечения элементарного брома, например с отгонкой паром или отдувкой воздухом. [9]
 |
Схема вытеснительного хроматографиче-ского разделения. [10] |
Электрохимическому выделению радиоактивных элементов препятствует адсорбция, которая может быть исключена добавлением десорбирую-щих веществ. Кроме того, электрохимическому выделению может препятствовать образование радиоколлоидов, поэтому процесс выделения рекомендуется вести в кислой среде. Как и в предыдущем случае, радиоактивный элемент может быть выделен этим способом в свободном состоянии без носителя. В случае получения радиоактивных элементов по ядерным реакциям, протекающим с изменением заряда ядра атома или в результате а - и - превращений радиоактивных элементов, имеется возможность выделения дочернего радиоактивного элемента в свободном состоянии. [11]
Электрохимическому выделению радиоактивных изотопов препятствует адсорбция, которая может быть предотвращена путем добавления десорбирующих веществ. Кроме того, электрохимическому выделению может препятствовать образование радиоколлоидов; процесс выделения поэтому рекомендуется вести в кислой среде. Как и в предыдущем случае, радиоактивный изотоп может быть выделен этим способом в свободном состоянии без носителя. [12]
Электрохимическому выделению радиоактивных изотопов препятствует адсорбция, которая может быть предотвращена путем добавления десорбирующих веществ. Кроме того, электрохимическому выделению может препятствовать образование радиоколлоидов; процесс выделения поэтому рекомендуется вести в кислой среде. Как и в предыдущем случае, радиоактивный изотоп может быть выделен этим способом в свободном состоянии без носителя. В случае получения радиоактивных изотопов по ядерным реакциям, протекающим с изменением заряда ядра атома или в результате а - и 3-превращений радиоактивных изотопов, имеется возможность выделить дочерний радиоактивный изотоп в свободном состоянии электролизом. [13]
Теория электрохимического выделения вольфрама из расплавов в литературе освещена недостаточно. [14]
Процессы электрохимического выделения других газов, в частности кислорода, являются более сложными, чем выделение водорода. [15]
Страницы: 1 2 3 4