Электрохимическое выделение - металл
Cтраница 2
Невозможность объяснить все кинетические особенности электрохимического выделения металлов с какой-либо одной общей точки зрения заставляет искать новые пути истолкования этих процессов и прибегать к предположениям частного характера. При этом предполагают, что одно-электронные реакции протекают практически без торможения. В тех случаях, когда только один злектрон участвует в акте разряда ( или когда процесс можно разбить на ряд последовательных одноэлектронных стадий), перенапряжение должно быть низким. Если в разряде ионов металла участвуют одновременно два электрона, то следует ожидать появления высокого металлического перенапряжения. [16]
Несмотря на все особенности протекания процессов электрохимического выделения металлов, создающие серьезные трудности при проведении экспериментов и теоретической интерпретации их результатов, к настоящему времени уже накоплен значительный фактический материал и сформировались определенные взгляды на природу этих процессов. [17]
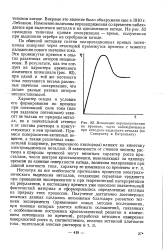 |
Изменение перенапряжения. [18] |
Несмотря на все особенности протекания процессов электрохимического выделения металлов, создающие серьезные трудности при проведении экспериментов и при теоретической интерпретации их результатов, к настоящему времени уже накоплен значительный фактический материал и сформировались определенные взгляды на природу этих процессов. [19]
Особый интерес представляют исследования влияния электрофоретического осаждения полимера на электрохимическое выделение металлов и исследования электроосаждения металлов и полимеров на металлополимерных электродах. [20]
По сравнению с процессами, связанными с выделением газов, реакции электрохимического выделения металлов имеют ряд специфических особенностей. При установлении природы замедленной стадии, определяющей перенапряжение реакции, недостаточно ограничиваться обычными г ля электродных процессов стадиями. [21]
По сравнению е процессами, связанными с выделением газов, реакции электрохимического выделения металлов имеют ряд специфических особенностей. При установлении природы замедленной стадии, определяющей перенапряжение реакции, недостаточно ограничиваться обычными гля электродных процессов стадиями. [22]
Операции, при которых образуются растворы или промывные воды, содержащие цианистые соединения: к ним относятся основные процессы электрохимического выделения металла из цианистых солей ( цинкование, кадмирование, меднение, серебрение), а также операции промывки после этих процессов. [23]
В случае неактивных веществ я применял прозрачный для световых лучей электрод, представляющий собой стеклышко, покрытое путем катодного распыления тонким слоем металла, и измерял возрастание оптической плотности при электрохимическом выделении металла ( см. рис. 12, стр. Этот метод позволяет, в частности, обнаруживать следы металла в количестве примерно 10 - 7 г и изучать их электрохимическое поведение. [24]
Как отмечалось выше, изучение выделения металлов на ртути и растворения амальгам имеет преимущество большей простоты по сравнению с изучением электрохимии твердых металлов. Во-первых, электрохимическое выделение металла на жидком электроде не сопровождается сложными явлениями образования кристаллических зародышей и роста кристаллов, а также и деформирующим влиянием кристаллического строения металла электрода на осадок. Во-вторых, неоднородность жидкой электродной поверхности неизмеримо меньше, чем твердой, и легче поддается учету. [25]
К аналогичному выводу ранее пришел Латин [14] относительно системы припой - флюс - медь. Латин указал, что электрохимическое выделение металла припоя на медь протекает особенно интенсивно вблизи участков соприкосновения расплава припоя с медью, где образуются локальные элементы. Действие этих элементов, а не воздействие флюса, как средство очистки поверхности предопределяет хорошее растекание припоя. [26]
Чистые хлориды редкоземельных металлов, тория и их смеси с хлоридами щелочных металлов являются одними из наиболее-важных исходных соединений для получения металлов. При этом используются методы металлотермического восстановления хлоридов [359-363] и методы электрохимического выделения металлов из расплавленных сред [364-368], поэтому сведения по химии хлоридов весьма своевременны и необходимы. [27]
Для этой цели можно было бы применить описанный выше метод, но для получения нужной толщины металла путем катодного распыления потребовалось бы значительное время. В случае, когда слой металла не может быть получен непосредственно путем прокатки и возможно электрохимическое выделение металла, можно применить следующий способ. [28]
В отличие от электролиза с выделением газов, где фазовое превращение хотя и совершается, но существенно не влияет на кинетику электрохимического процесса, при электролитическом выделении металлов эта стадия имеет очень большое, а иногда и решающее значение. Значение этой стадии было отражено В. А. Кистяков-ским уже в самом названии электрокристаллизация, предложенном им для процессов электрохимического выделения металлов. Процессы электрокристаллизации металлов должны иметь общие черты с другими фазовыми превращениями, в первую очередь, с образованием твердой фазы. [29]
В отличие от электролиза с выделением газов, где фазовое превращение хотя и совершается, но существенно не влияет на кинетику электрохимического процесса, при электролитическом выделении металлов эта стадия имеет очень большое, а иногда и решающее значение. Значение этой стадии было отражено В. А. Кистяковским уже в самом названии электрокристаллизация, предложенном им для процессов электрохимического выделения металлов. Процессы электрокристаллизации металлов должны иметь общие черты с другими фазовыми превращениями, в первую очередь с образованием твердой фазы. [30]
Страницы: 1 2 3