Электрохимическое выделение - водород
Cтраница 2
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Опытные данные по величинам токов обмена и наклону тафелевских прямых указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. Кобозев и Монбланова ( 1935) доказали медленное протекание стадии рекомбинации на электродах из палладия. При наложении катодного тока на поляризационную сторону мембраны и смещении ее потенциала в отрицательном направлении выделение водорода вначале происходит только на поляризационной стороне, а затем и на диффузионной. [16]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Опытные данные по величинам токов обмена и наклону тафелевских прямых указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. Кобозев и Монбланова ( 1935) доказали возможность замедленного протекания стадии рекомбинации на электродах из палладия. При наложении катодного тока на поляризационную сторону мембраны и смещении ее потенциала в отрицательном направлении выделение водорода вначале происходит только на поляризационной стороне, а затем и на диффузионной. [17]
 |
Схема перехода водорода. [18] |
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. [19]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож па платину. Данные опыта ( токи обмена и наклон тафелевских прямых) указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. [20]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Данные опыта ( токи обмена и наклон тафелевских прямых) указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. [21]
При анодной поляризации постепенно прекращается не только электрохимическое выделение водорода ( так как компенсирующим становится отвод электронов во внешнюю цепь), но происходит ионизация и водорода дегидрирования. Газовыделение на электроде постепенно прекращается. [22]
В работе А. И. Левина и В. М. Рудого влияние кристаллографической неоднородности рассмотрено на примере реакции электрохимического выделения водорода. [23]
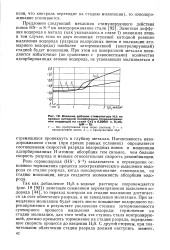 |
Влияние добавок стимулятора H2S на кривые катодной поляризации ( перенапряжение водорода на стали СтЗ в 0 00001 н. H2SO4 ( рН 5. [24] |
Роль сероводорода ( HS -, S-2) заключается в переведении основного торможения процесса электрохимического выделения водорода со стадии разряда, когда наводороживание невозможно, на стадию молизации, когда создается возможность абсорбции водорода. [25]
Наиболее часто для процессов электросинтеза органических веществ в качестве растворителя используется вода, поэтому реакции электрохимического выделения водорода и кислорода в результате разложения воды оказывают влияние на протекание электросинтеза органических веществ. [26]
Среди электродных реакций, исследование которых актуально с обеих точек зрения, одно из первых мест несомненно принадлежит реакциям электрохимического выделения водорода. История исследования этих реакций начинается классическими работами Тафеля, который в 1905 г. установил существование линейной зависимости логарифма тока от перенапряжения - закона, справедливого для подавляющего большинства электродных реакций и носящего его имя. Установление механизма элементарных стадий электрохимического выделения водорода связано с именами таких крупных физико-химиков нашего времени, как А. Н. Фрум-кин, Я. [27]
Влияние природы катионов фона на кинетику электродных процессов, по-видимому, впервые было обнаружено Герасименко и Шлендыком [197], которые изучали электрохимическое выделение водорода в присутствии различных солей щелочных и щелочноземельных металлов. [28]
Из полученных экспериментальных данных можно сделать заключение, что повышение концентрации атомарного водорода на поверхности электрода может как замедлять, так и ускорять процесс электрохимического выделения водорода 12 ], причем с увеличением г ] тормозящее действие атомарного водорода уменьшается, а при высоких rj атомарный водород ускоряет процесс электрохимического выделения водорода. [29]
Страницы: 1 2 3