Электрохимическое выделение - водород
Cтраница 3
Так как на металлах второй электрохимической группы акт разряда ионов водорода требует значительной энергии активации, для них появляется возможность участия самих молекул ингибитора в процессе электрохимического выделения водорода. [31]
В настоящем обзоре показано, что сочетание двух моделей, учитывающее, что перенос электрона сопровождается как перестройкой полярной среды, так и движением протона, позволяет количественно объяснить особенности реакций электрохимического выделения водорода. Константа скорости эндотермической реакции разряда ионов водорода описывается аррениусовской зависимостью, в которой энергия активации преимущественно связана с перестройкой среды. Для быстрой экзотермической реакции электрохимической десорбции ( образования молекулы водорода из адсорбированного атома водорода, оксониевого иона и электрона металла) скорость реакции определяется туннельным переходом электрона из металла в реакционный комплекс и не зависит от температуры. Обе реакции характеризуются изотопным эффектом, падающим с уменьшением энтальпии реакции. [32]
Во второй группе систем газовыделение на неполяризованном электроде, по-видимому, складывается из двух частей: а) дегидрирования реагента по реакциям ( 2) и ( 3), б) электрохимического выделения водорода по реакции ( 1), компенсирующего процесс электрохимического окисления органической молекулы. [33]
Таким образом, из обзора работ по механизму разложе - ния амальгам щелочных металлов в растворах электролитов вытекает, что в значительной области рН существует глубокая аналогия между механизмом выделения водорода при разложении амальгам и электрохимическим выделением водорода на ртутных катодах. [34]
В 1933 г. Брдичка открыл интересный вид катализа под действием белковых молекул [330], сущность которого состоит в том, что на полярограмме кобальта при добавлении белковых веществ вслед за волной восстановления Со11 появляется еще одна волна, которая связана с каталитическим действием сульфгидрильных групп белка на электрохимическое выделение водорода. [35]
Из полученных экспериментальных данных можно сделать заключение, что повышение концентрации атомарного водорода на поверхности электрода может как замедлять, так и ускорять процесс электрохимического выделения водорода 12 ], причем с увеличением г ] тормозящее действие атомарного водорода уменьшается, а при высоких rj атомарный водород ускоряет процесс электрохимического выделения водорода. [36]
Хотя в общем приведенные выше представления о каталитическом действии белков в присутствии ионов кобальта являются логичными и достаточно обоснованными, по-видимому сложность и большое разнообразие накладываемых друг на друга элементарных процессов, связанных в том числе и со сложным строением и поведением белковых макромолекул на поверхности электрода, заставляет многих исследователей проводить дальнейшие поиски более точного механизма рассматриваемых процессов, с учетом большого разнообразия факторов и их влияния на процесс катализа реакции электрохимического выделения водорода. [37]
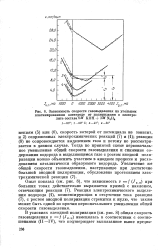 |
Зависимость скорости газовыделения на угольном платинированном электроде от поляризации в электролите состава Ш КОН ЗМ N2H4. [38] |
Реакция электрохимического выделения водорода ( 1), компенсирующая в отсутствие тока реакцию ( 7), с ростом анодной поляризации стремится к нулю, что также может быть одной из причин первоначального уменьшения общей скорости газовыделения. [39]
Ионы кобальта катализируют реакции разложения Н2О2 и окисления о-дифенолов пероксидом водорода в щелочной среде. В присутствии некоторых комплексов кобальта происходит каталитическое электрохимическое выделение водорода. Для определения кобальта применяют также хемилюминесцентные реакции окисления люминола, люцигенина и галловой кислоты. [40]
В качестве катализатора мы использовали платину, а носителями служили гладкие углеродистые материалы и золото. Для выбранного катализатора и носителей очень удобными модельными реакциями являются адсорбция и электрохимическое выделение водорода, адсорбция метанола и муравьиной кислоты и их электрохимическое окисление. Скорость этих процессов на платине на несколько порядков больше, чем на угле и золоте, поэтому вкладом чистого носителя в суммарную скорость процессов можно пренебречь. [41]
К числу наиболее фундаментальных проблем физической химии относится перенос электрона, в частности, через границу раздела раствор электролита - металл. Поэтому вполне понятно стремление на квантовохимическом уровне объяснить закономерности и особенности реакций электрохимического выделения водорода. [42]
Страницы: 1 2 3