Гидроокись - скандий
Cтраница 3
Мишень из кальция после облучения растворяют в соляной кислоте, к раствору добавляют хлористый калий и хлористый скандий в количестве нескольки десятков миллиграммов. Далее производят осаждение гидроокиси скандия раствором аммиака. Кальций из фильтрата осаждают в виде щавелевокислой соли, а калий-или в виде кобальти-нитрита, или в виде перхлората из спиртового раствора. Каждый из осаждаемых элементов растворяют и переосаждают несколько раз, с тем чтобы получить чистый радиоактивный препарат. [31]
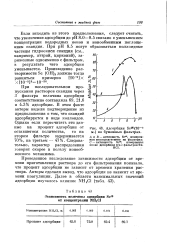 |
Адсорбция Se ( lQ - e м. на бумажных фильтрах. [32] |
Если исходить из этого предположения, следует считать, что увеличение адсорбции до рН 8.0 - 8.5 связано с уменьшением концентрации водородных ионов и ионообменным поглощением скандия. При рН 8.5 могут образоваться коллоидные частицы гидроокиси скандия ( см., например, иттрий, цирконий), заряженные одноименно с фильтром, в результате чего адсорбция уменьшается. [33]
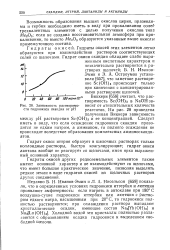 |
Зависимость растворимо - висит от относительных количеств сти гидроокиси скандия от рН реагентов. На 28 приведена. [34] |
Следует иметь в виду, что если юсаждение гидроокиси скандия проводится не едким натром, а аммиаком, то полного осаждения не происходит вследствие образования комплексных амминосканди-атов. [35]
Практически использовать этот метод для отделения РЗЭ можно лишь при очень строгом регулировании рН и из сильно разбавленных растворов [ 2, стр. Метод не дает возможности отделить Fe3, в присутствии которого гидроокись скандия осаждается при более низком рН, чем из чистых растворов [ 2, стр. При увеличении концентрации NaOH до 20 % растворимость Sc ( OH) 3 возрастает до 7 5 мг / 100 г раствора. [36]
Гидроокись скандия образуется через промежуточную основную соль состава Sc ( OH) 2NO3, которая выделяется в начале осаждения. При дальнейшем прибавлении осадителя и нагревании она почти полностью переходит в гидроокись скандия. [37]
При этом выжигаются летучие компоненты. Твердый остаток разлагают концентрированной серной кислотой, добавляют воду и аммиаком осаждают из раствора гидроокись скандия. Затем ее высушивают и прокаливают в газовой печи при 600 - 700 С. В результате получают светло-розовый порошок окиси скандия с довольно значительными примесями твердой кремневой кислоты и различных окислов, в первую очередь окиси железа. Эти примеси можно удалить, растворяя порошок в чистой соляной кислоте с последующим выделением разных фракций. Кремневую кислоту удаляют с помощью раствора желатины, а образовавшееся хлорное железо - методом эфирной экстракции. [38]
Некоторые комплексные фториды скандия легкорастворимы в воде и довольно устойчивы. Например, из раствора ( NH) d [ ScFe ] при действии NH4OH гидроокись скандия не выделяется. [39]
Некоторые комплексные фториды скандия легкорастворимы в воде и довольно устойчивы. Например, из раствора ( NH4) 3 [ ScF6 ] при действии NH4OH гидроокись скандия не выделяется. [40]
Аммиак осаждает скандий количественно; осадок очень слабо растворим в аммиаке, но легко растворим в карбонате аммония. Фторид аммония может полностью воспрепятствовать осаждению, тогда как оксалат аммония лишь ослабляет его. Гидроокись скандия не выделяется полностью также при осаждении растворами едких щелочей, причем потери значительно увеличиваются в присутствии органических кислот ( лимонной и винной) или солей аммония. Вместе с тем, как указывает Е. Б. Сендел [44], при осаждении аммиаком в присутствии алюминия ( для отделения от щелочноземельных элементов) потери заметных количеств скандия в фильтрат маловероятны. Полное осаждение гидроокиси скандия едким натром возможно в присутствии металлов, не образующих амфотерных гидроокисей, причем Сендел считает наиболее подходящим для этой цели кобальт ( II), имеющий ионный радиус, близкий к ионному радиусу скандия. [41]
Все эти элементы не имеют каких-либо признаков II и IV групп периодической системы. Скандий, иттрий, лантан и актиний образуют труднорастворимые гидроокиси основного характера. Сравнительно слабо выраженная основность гидроокиси скандия указывает на отклонение его из ряда аналогов ( скандий-иттрий-лантан-актиний) вправо. [42]
Ca, A1, РЗЭ, Ti, Mn, обрабатывают серной кислотой, а затем проводят водное выщелачивание. Указанные примеси в этих условиях остаются в растворе. В осадок вместе с гидроокисью скандия выделяются Ti, Mn и другие примеси. Для очистки от Ti, Mn, остатков А1 осадок гидроокисей растворяют в соляной кислоте и осаждают скандий щавелевой кислотой. Прокаливая при 600, оксалаты переводят в окиси. [43]
Ca, A1, РЗЭ, Ti, Mn, обрабатывают серной кислотой, а затем. Указанные примеси в этих условиях остаются в растворе. В осадок вместе с гидроокисью скандия выделяются Ti, Мп и другие примеси. Для очистки от Ti, Mn, остатков Al осадок гидроокисей растворяют в соляной кислоте и осаждают скандий щавелевой кислотой. Прокаливая при 600, оксалаты переводят в окиси. [44]
Эфират триэтилскандия, как сообщалось, был получен при помощи реактива Гриньяра [8], однако эта работа вызывает сомнение [6], так как указанный в ней выход стехиометрически невозможен, а сам эксперимент повторить не удалось. CsHg Sc нерастворим в углеводородах, но легко растворим в тетрагидрофуране и диметиловом эфире этиленгли-коля. Он гидролизуется водой, давая циклопентадиен и гидроокись скандия, а с хлоридом железа ( II) втетрагидрофурановом растворе мгновенно реагирует, давая ферроцен ( С5Н5) 2Ре; эта реакция является, по-видимому, ионной реакцией обмена. [45]
Страницы: 1 2 3 4