Гидроокись - таллий
Cтраница 2
Выпадает бурый осадок гидроокиси таллия. [16]
Сильно основной характер гидроокиси таллия ( 1) соответствует общему правилу, что окислы и гидроокиси, отвечающие низшим степеням окисления элементов, всегда имеют более основной ( или менее кислый) характер, чем соответствующие высшим степеням окисления. Уменьшение кислотных свойств при переходе от борного ангидрида к окиси алюминия и связанное с этим увеличение основного характера объясняются теми же причинами, что и возрастание основного характера при переходе от гидроокиси лития к гидроокиси цезия и от гидроокиси бериллия к гидроокиси бария. Ионы элементов главной подгруппы III группы с зарядом 3 в своих гидроокисях сильно притягивают ионы кислорода и сравнительно столь же сильно отталкивают ионы водорода. Это и происходит в том случае, если объем центрального иона невелик. Отталкивающим действием трехзарядного положительного иона бора на ионы водорода объясняется также неспособность бора к существованию в водном растворе в виде свободного положительного иона. [17]
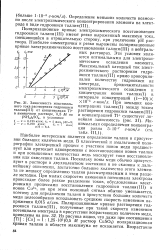 |
Зависимость максимального тока растворения гидроокиси таллия ( Ш от концентрации Т1 в аммиачном растворе, 0 5 М по ( NH4 2SO4, в условиях. [18] |
Поляризационные кривые электрохимического восстановления гидроокиси таллия ( III) имеют резко выраженный максимум тока, смещающийся в отрицательную сторону, при увеличении рН раствора. Наиболее симметричны и резко выражены поляризационные кривые электрохимического восстановления таллия ( III) в нейтральных растворах. Эти условия являются оптимальными для электрохимического осаждения элемента. [19]
Получающаяся в результате реакции окисления гидроокись таллия хорошо растворяется в воде и быстро переходит в раствор в виде ионов таллия и гидроокиси. Гидроокись таллия является сильным электролитом, который повышает удельную электропроводность раствора на значение, пропорциональное содержанию растворенного в воде кислорода. [20]
Объяснение результатов измерений Жоба образованием недиссоциированной гидроокиси таллия в сильноосновных растворах, по мнению автора, исключается, так как легко растворимая гидроокись таллия известна как сильное основание с почти нормальным коэффициентом электропроводности. Предполагаемый порядок величины константы гидролиза для иона таллия ( I) приведен в табл. 9, стр. [21]
Едкие щелочи и аммиак осаждают бурую гидроокись таллия Т1 ( ОН) з из растворов солей трехвалентного таллия, которая при стоянии на воздухе переходит в ТЮ ( ОН); Т1 ( ОН) з трудно растворяется в кислотах и не растворяется в избытке едких щелочей. [22]
Образующаяся в процессе окисления гидратированная двуокись марганца сорбирует гидроокись таллия, что содействует более полному ее осаждению. [23]
Для получения чистого металлического таллия технический хлорид или гидроокись таллия химическим путем переводят в чистый сульфат таллия. [24]
Разработанный авторами метод, основанный на титримет-рическом определении концентрации гидроокиси таллия ( реакция 1), в значительной мере лишен указанных недостатков. [25]
По методу Мензиса [108] метилирование полисахаридов ведут йодистым метилом в присутствии гидроокиси таллия. [26]
В кислой среде ( например, в присутствии уксусной кислоты), гидроокись таллия окисляет бензидин с образованием продуктов, окрашенных в синий цвет. [27]
Циклопентадиенилталлий ( I) легло образуется при добавлении циклопентадиена к водному раствору гидроокиси таллия или соли таллия в присутствии щелочи И6; предполагается, что соединение имеет солеподобную структуру. [28]
В таллиевой колонке растворенный в пробе кислород реагирует с металлическим таллием с образованием гидроокиси таллия. Из таллиевой колонки проба через вторую измерительную ячейку поступает в катионитовый фильтр для улавливания соединений таллия, являющихся токсичными веществами. Очищенная проба, пройдя контрольную кондуктометриче-скую ячейку и ротаметр, сбрасывается в дренаж. [29]
Если надо провести метилирование миллиграммовых количеств полисахарида, можно просто лиофилизовать смесь полисахарида и гидроокиси таллия ( 1) ( см. стр. На этой стадии необходимым условием является полное отсутствие влаги, а доступ света должен быть максимально ограничен. Часто лучше проводить реакцию с йодистым метилом в автоклаве при 100; в этом случае для нейтрализации могущей образоваться кислоты добавляют окись таллия ( 1) или окись серебра ( см. примечание на стр. Когда смесь перестает быть щелочной ( примерно через 60 час), ее упаривают при 30 и остаточном давлении 10 мм. Нейтральные полисахариды отделяют от иодида таллия растворением в кипящем метаноле; полисахариды, содержащие большое количество уроновых кислот или сульфатных групп, по-видимому, остаются в осадке вместе с иодидом таллия ( 1), и для их выделения необходимо провести экстракцию горячей водой. [30]
Страницы: 1 2 3 4