Гидроперекись - метил
Cтраница 2
Было доказано даже в случае метана и этана, что продуктами реакции являются гидроперекиси метила СН3ООН и соответственно этила CSH6OOH, которые были выделены в чистом состоянии. Нормальное горение углеводородов также протекает с первоначальным образованием гидроперекисей. [16]
Чане считает, что идентичность полос Соре в перекисных комплексах с Н2О2 и гидроперекисью метила или этила указывает на то, что замещение в молекуле Н2О2 не влияет на природу связи железо-перекись. Теорелл [20, 51] исходя из магнетохимических исследований предположил, что эта связь во вторичных бледнокрасных комплексах ковалентна, в то время как сравнение спектров первичных зеленых комплексов с зеленым фторид-пероксидазным комплексом, связи в котором, как известно, ионные, показывает, что в этих первичных комплексах связь ионная. [17]
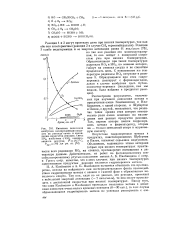 |
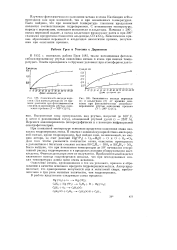
Кинетика окисления изобутана озонированным воздухом по расходу озона и накоплению продуктов реакции. Смесь. [18] |
Клейменов и А. Б. Налбандян пытаются объяснить это противоречие, исходя из найденного ими экспериментального факта взаимодействия гидроперекиси метила с озоном в газовой фазе с образованием метилового спирта. Так как, судя по их данным, эта реакция, протекает с небольшой энергией активации ( - 7 ккал / молъ), то она может происходить с достаточной скоростью при низких температурах. Ввиду того, что сами Клейменов и Налбандяи проводили окисление метана с добавками озона при очень малых временах контакта ( 6 - 30 сек. [19]
Они нашли, однако, что в кислой среде ( в 0 01 N HCI) гидроперекись метила восстанавливается при потенциале - 0 7 в, перекись этила - при потенциале - 0 6 в, а перекись водорода - при потенциале - 0 8 в. Такие результаты не давали, понятно, возможности различить алкильные перекиси в присутствии перекиси водорода. [20]
Окисление метана, проводившееся в тех же условиях, привело к образованию в качестве основного продукта гидроперекиси метила. Автор предполагает, что одновременно получается еще и метиловых. [22]
В фотохимических опытах А. Б. Налбапдяна было показано, что при окислении метана в условиях комнатной температуры основным промежуточным продуктом является гидроперекись метила. [23]
Согласно данным опытов Неймана с сотрудниками [25], при впуске паров органической перекиси ( диэтилперекиси - ( СзНвЬОО, или гидроперекиси метила - СНзООН) в нагретый кварцевый сосуд при 210 - 250 и давлениях 5 - 13 мм рт. ст. наблюдается взрывной распад перекиси с характерным для холодного пламени свечением. [24]
Клейменов и Налбандян считают, что при столь больших временах не исключено протекание вторичных реакций, приводящих к дальнейшему превращению гидроперекиси метила в метиловый спирт, а формальдегида в муравьиную кислоту. [25]
Согласно данным опытов Неймана с сотрудниками [25], при впуске паров органической перекиси ( диэтилперекиси - ( С2Н5) гОО, или гидроперекиси метила - СНзООН) в нагретый кварцевый сосуд при 210 - 250 и давлениях 5 - 13 мм рт. ст. наблюдается взрывной распад перекиси с характерным для холодного пламени свечением. [26]
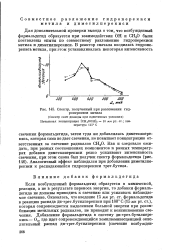 |
Спектр, полученный при разложении гидроперекиси метила. [27] |
Для дополнительной проверки вывода о том, что возбужденный формальдегид образуется при взаимодействии ОН и СН30 были поставлены опыты по совместному разложению гидроперекиси метила и диметилперекиси. [28]
В изложенном выше доказательстве, устанавливающем природу элементарного акта, приводящего к образованию возбужденного формальдегида, наименее надежным, по-видимому, может показаться использование гидроперекиси метила как источника метоксильных и гидроксильных радикалов. И дело не столько в отсутствии констант, характеризующих чистоту гидроперекиси метила ( для полученных качественных результатов это не так важно), сколько в том, что при разложении гидроперекиси метила выделяется некоторое количество кислорода [335], возможная роль которого в наблюдающейся хемилюминесценции должна быть оценена. Необходимо проверить, не являются ли реакции кислорода с теми или иными радикалами источником свечения формальдегида. [29]
Они обладают слабокислыми свойствами и способны давать соли с щелочными и щелочноземельными металлами. Гидроперекись метила при действии щелочей разлагается с образованием водорода, муравьиной кислоты и метилового спирта. [30]
Страницы: 1 2 3