Диффузия - ион - кислород
Cтраница 1
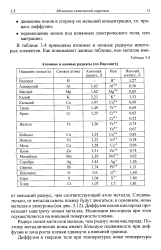 |
Атомные и ионные радиусы ( по Паулингу. [1] |
Диффузия ионов кислорода происходит навстречу ионам металла. Ионизация кислорода при этом осуществляется на внешней поверхности пленки. [2]
Скорость диффузии ионов кислорода и, следовательно, скорость коррозии циркония возрастают с увеличением концентрации и подвижности вакансий. Если в металле присутствует азот, переходящий в процессе коррозии в окисную пленку, то трехвалентные ионы азота могут заместить кислородные ионы в окисной решетке. В связи с этим возникают новые вакансии. Такие вакансии несколько менее подвижны, чем обычно имеющиеся, так как они должны быть связаны с ионами азота, но в целом скорость диффузии, а соответственно и коррозии, возрастает. При наличии 0 005 % ф водорода и 0 5 % кислорода скорость коррозии циркония увеличивается незначительно. При наличии же 0 1 % водорода и 1 % кислорода она уже увеличивается значительно и стойкость циркония заметно понижается. [3]
Непосредственные измерения диффузии иона кислорода были выполнены Кингери и др. [72] методом меченых атомов при температурах 700 - 1100 С. [5]
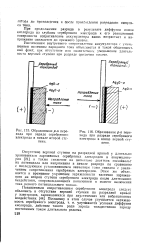 |
Образование р-п перехода при заряде серебряного электрода в начале второй ступени.| Образование р-п перехода при разряде серебряного электрода в конце первой ступени. [6] |
При продолжении разряда в результате диффузии ионов кислорода из глубины серебряного электрода к его реакционной поверхности сопротивление аккумулятора вновь возрастает и напряжение снижается до прежнего уровня. [7]
В свою очередь, скорость реакции ( VIII, 7) определяется скоростью диффузии иона кислорода в катализаторе. [8]
По-видимому, не встречается сомнений в отношении того, что скорость окисления зависит от скорости диффузии ионов кислорода через окалину из рутила. Возникает лишь вопрос о том, что же делается с углеродом, освобождающимся при реакции TiC ( О2) ТЮ2 С. Как показано аналитически, углерод присутствует в окалине в концентрациях приблизительно от 0 1 до 0 16 % [833, 835, 836], так что объяснение, возможно, заключается в том, что углерод как таковой диффундирует к поверхности окалины, где он, взаимодействуя с кислородом, образует окислы. Фактически Николайский обнаружил спектрометрически некоторое количество окиси углерода в кислороде над образцами карбида титана TiC, окислявшимися при 950 С, но ни С02, ни СО не было, когда окисление происходило при 750 С. Как установили Поллард и Вудуорд [837], газ над карбидом титана, окислявшемся при 1200 С, состоял почти нацело из СО. В карбиде титана всегда существует нехватка углерода ( 19 5 %, например, вместо 20 0 % [834]), тогда как термохимически карбид способен растворять его в стехиометрической пропорции. [9]
Этот эксперимент подтверждает наше предположение, что НТ-пик обусловлен диффузией ионов натрия, а СТ-пик - диффузией немостико-вых ионов кислорода, а сравнение результатов эксперимента с данными работы [2 ] еще раз свидетельствует об идентичности природы обоих максимумов в макро - и микрообразцах. [10]
Повышение температуры воды ведет к снижению ее вязкости и росту электропроводимости воды, а также к повышению скорости диффузии ионов кислорода или водорода. Поэтому скорость координирования при этом возрастает. [11]
Было предположено, что трехвалентные ионы азота в решетке ZrO2 повышают концентрацию анионного дефекта и тем самым увеличивают скорость диффузии ионов кислорода. Если бы такой механизм был правилен, то скорость окисления в О2 также должна была бы измениться, чего нет. Положение усложняется тем, что легирование оловом заметно повышает скорость коррозии циркония в воде, но при совместном легировании оловом и небольшими количествами железа, никеля и в меньшей степени хрома коррозионная стойкость повышается и вредное влияние азота исчезает. [12]
В настоящее время считается, что при окислении железа определяющими факторами являются диффузия ионов железа в слоях вюстита и магнетита и диффузия ионов кислорода в слое гематита. [13]
Установлено [6-8], что окисление чистого свинца подчиняется параболической закономерности g K YT при температурах до 550 С и определяется скоростью диффузии ионов кислорода. [14]
В области температур, представляющих интерес, быстро устанавливается рост окисла по линейному закону, а лимитирующей стадией процесса является, как обычно полагают, диффузия ионов кислорода через тонкий поверхностный слой окисла, обладающий адгезией и характеризующийся постоянной средней толщиной при данной температуре. В случае двуокиси углерода константа скорости сначала плавно возрастает с температурой, а вблизи температуры фазового перехода ( 5-у-металла ( 780 С) происходит резкое повышение скорости реакции, сопровождаемое некоторым самоподогревом за счет большой теплоты реакции. При дальнейшем повышении температуры до 1000 С скорость реакции остается постоянной или меняется слабо. Основная масса окисла образуется в форме сыпучего порошка ( размер частиц увеличивается с повышением температуры) или при более высоких температурах - в форме растрескавшейся окалины, обладающей адгезией к металлу. Отсутствие температурной зависимости константы скорости при высоких температурах объясняется именно формированием такой окалины и может быть связано со спеканием окисла или, что более вероятно, с освобождением растущих механических напряжений за счет пластической деформации окисла и верхнего слоя металла, а не за счет разрыва окисной пленки. [15]
Страницы: 1 2 3