Диффузия - ион - кислород
Cтраница 3
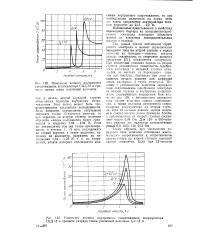 |
Изменение полного внутреннего сопротивления аккумулятора СЦД-12 в процессе заряда током различной величины. [31] |
Так, резкий скачок потенциала серебряного электрода в момент переключенля зарядного тока на второй ступени с малых значений на большие - явление, которое раньше связывалось со старением анодных продуктов [21], объясняется следующим. При медленных режимах заряда на второй ступени реакционная поверхность серебряного электрода в меньшей степени отличается по составу от переходного слоя, чем при быстрых, поскольку при этом создаются лучшие условия для диффузии ионов кислорода в глубь электрода. Поэтому с уменьшением величины зарядного тока сопротивление серебряного электрода на второй ступени и внутреннее сопротивление аккумулятора возрастают. Как видно из рис. 129, с уменьшением зарядного тока растет величина пика сопротивления, а также величина внутреннего сопротивления аккумулятора на второй ступени. [32]
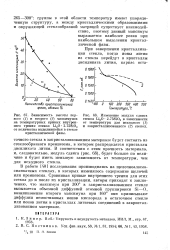 |
Зависимость высоты первого ( 1 и второго ( 2 максимумов на температурных кривых внутрен.| Изменение модуля сдвига стекол Ы2О SiO2 в зависимости от температуры для исходного ( 1. [33] |
Сравнивая кривые внутреннего трения для этих стекол до и после их кристаллизации, авторы приходят к заключению, что максимум при 300 в закристаллизованном стекле вызывается объемной диффузией атомной группировки Si-О, возникновение второго максимума при 160 они приписывают диффузии немостиковых ионов кислорода в остаточном стекле или ионов лития в кристаллах литиевых соединений в закристаллизованном материале. [34]
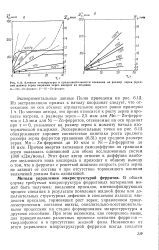 |
Влияние температуры и продолжительности спекания на размер зерен ( средний размер зерен выражен через квадрат их медиан. [35] |
По мнению автора, это время относится к росту зерна в процессе нагрева, а размеры зерен - 2 5 мкм для Мп - Zn-ферритов и 1 5 мкм для Ni - Zn-ферритов, отсекаемые на оси ординат при т 0, указывают на размер зерен к моменту начала изотермической выдержки. Экспериментальные точки на рис. 6.12 обнаруживают хорошее соответствие кинетики роста среднего размера зерна ферритов уравнению (6.31) при среднем размере зерна Мп - Zn-ферритов до 10 мкм и Ni - Zn-ферритов до 18 мкм. Этот факт автор относит к диффузии наиболее медленного иона кислорода и приходит к общему выводу о том, что в ферритах с решеткой шпинели скорость роста зерна не зависит от состава и при отсутствии тормозящего влияния включений должна быть одинаковой. [36]
Не исключено, что здесь действует истинный вагнеровский механизм, а отклонение от параболического окисления обусловлено старением или каким-нибудь иным вторичным явлением. Опыты Хиригоса и Томаса с индикаторами [700] могут свидетельствовать о том, что диффузия ионов кислорода О2 - в двуокиси циркония ZrO2 осуществляется через анионные вакансии. [37]
Для реакционных печей были предложены различные усовершенствования. Так, Бурке [3] обнаружил, что нанесение на песок слоя, состоящего из смеси силиката натрия и NaOH с заданным отношением Si02: Na20 в интервале от 2 5: 1 до 4: 1, и последующее нагревание частиц песка в образующейся суспензии в пламени до температуры выше 1920 С позволяют сформировать растворимое стекло в виде однородных частиц. Было обнаружено [7], что при атмосферном давлении продуктом реакции в граничной зоне системы Si02 - расплав Na2C03 является метасиликат натрия, тогда как в вакууме скорость реакции понижается и метасиликат не обнаруживается. Диффузия ионов кислорода через пограничные слои силиката позволяет регулировать скорость реакции, но диффузия ионов натрия на скорость не влияет. Трухларова и Вепрек [8] нашли, что скорость растворения плавленого кремнезема в расплаве Si02 - Na20 имела энергию активации в температурном интервале 1050 - 1250 С, равную 29 8 ккал / моль. [38]
Согласно принятым моделям центров рекомбинации неравновесных носителей заряда и уравнению ( 10), рост положительной фэп может быть обусловлен либо уменьшением концентрации вакантных узлов в кислородной подрешетке окисла, либо увеличением концентрации вакансий в металлической подрешетке. Очевидно, что уменьшение Концентрации анионных вакансий, как и увеличение концентрации катионных, свидетельствует о том, что в области потенциалов, отвечающей росту положительной фэп, при анодном формировании окисла в зону реакции кислород поступает в большем, а серебро в меньшем количестве. Иными словами, имеет место преимущественная диффузия ионов кислорода. Поскольку диффузия ионов кислорода по междоузлиям маловероятна по стерическим соображениям, можно предположить, что кислород в Ag2O диффундирует по имеющимся анионным вакансиям. Аналогичным образом можно показать, что, поскольку падение положительной фэп после максимума связано либо с уменьшением концентрации катионных вакансий, либо с увеличением концентрации анионных, анодное окисление серебра до Ag2O на этом участке носит преимущественно катионный характер. [39]
Закон роста окисла до - 500 С является логарифмическим, однако достигаемые толщины слишком велики, чтобы их можно было объяснить переносом под действием электрического поля. Поэтому следует искать другие причины, например образование полостей. Действительный механизм до сих пор не установлен. Выше 550 С действует параболический закон окисления при направленной внутрь диффузии ионов кислорода. Выше 850 С отмечается паралинейный рост окисла. Окалина состоит из внутреннего плотного слоя постоянной толщины и наружного пористого утолщающегося слоя окислов. Первоначально утолщение происходит по параболическому закону, но через некоторый период времени скорость окисления становится постоянной, соответствующей формированию внешнего слоя. [40]
Например, активность Fe3O4 и Ре2Оз резко возрастает только при почти полном восстановлении и при этом увеличивается поверхность чистого Fe. Аналогичный результат получен и для дважды промотированного железного катализатора. Характерно, что удельная поверхность при полном восстановлении Fe2O3 и Fe3O4 увеличивается всего в 4 - 5 раз, а активность - в 70 - 80 раз, причем только 1 % невосстановленных окислов резко снижает активность. Возможно, что поверхность покрывается кислородом за счет выделения паров Н2О при восстановлении и диффузии ионов кислорода из объема на поверхность. В работе [316] показано, что введение А12О3 и А12О3 К2О в окислы железа затрудняет восстановление, но железо на поверхности и активность в реакции синтеза NH3 появляются уже при средних степенях восстановления. [41]
Если не считать отклонений на начальных стадиях, то окисление протекает по параболической закономерности. Катастрофического окисления не Наблюдается. Сложный окисел NiMoO4 образуется на внутренней поверхности NiO вследствие диффузии ионов молибдена наружу, а окисел МоО2 возникает в сплаве благодаря диффузии ионов кислорода внутрь. Движущей силой диффузии ионов О2 внутрь должна быть разность между давлением диссоциации NiMoO4 и парциальным давлением кислорода в сплаве. Начальное убыстрение окисления можно было бы объяснить образованием в NiO дополнительных вакансий и последующим уменьшением их числа, возможно при уплотнении внутренних окислов. [42]
Страницы: 1 2 3