Валентная группа
Cтраница 1
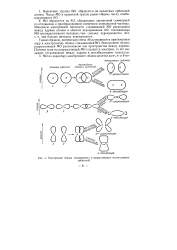 |
Электронные облака связывающих и разрыхляющих молекулярных. [1] |
Валентная группа МО образуется из валентных орбиталей атомов. [2]
Эта валентная группа возникает в упомянутых выше ( разд. [3]
При этом валентная группа каждого атома включает более восьми электронов. В случае фтора расширение валентной группы невозможно, так как фтор в отличие от хлора и др. не имеет незанятых орбит с достаточно низкой энергией. [4]
Каждый сектор соответствует валентной группе. [5]
Межгалоидный ион IClj имеет валентную группу ( 6 4), и можно ожидать, что три неподеленные пары будут занимать три положения в экваториальной плоскости три-гональной бипирамиды, так что ион будет иметь линейную конфигурацию. Это также подтверждается опытом. [6]
Например, в то время как валентные группы в SbCls ( 2, 6) и в SbF6 ( 10) нормальны, группы в 1С13 ( 4 6) и в IF6 ( 2 10) согласуются с вышеприведенной гипотезой только в том случае, если мы их напишем соответственно как ( 2) 2 6 и ( 2) 10, предполагая, что два электрона ведут себя так, как если бы они находились в основном остове атома. [7]
Лишь у немногих молекул / имеется валентная группа из десяти или четырнадцати электронов, но для них возникает затруднение, связанное с тем, что не существует идеально правильных фигур с пятью или семью вершинами. [8]
 |
Схема МО молекул N2, O2, F2 и т. д., получения упрощенным методом. [9] |
Каждый из взаимодействующих атомов имеет в валентной группе одну s - и три р-орбитали. Если расположить ядра атомов вдоль оси z, то орбитали рх и ру обоих атомов взаимодействуют, давая две п-связывающие и две я - разрыхляющие МО. [10]
Октаэдрические комплексы Те ( IV) соответствуют 14-электронноп валентной группе. Тщательные рентгеновские исследования ( NH - ihTeCIe [1] и KzTeBr6 [2, 3] показывают, что анионы в этих соединениях имеют правильную октаэдрическую форму и являются исключением из общего правила, согласно которому конфигурация связей, образованных непереходными элементами, соответствует наиболее симметричному размещению общего числа связывающих и неподеленных пар электронов. Электронные спектры этих солей дают основание полагать, что 552-электроны частично делокализова - - гш в направлении галогенидных лигандов. [11]
Существование ковалентных соединений, в которых атом металла имеет смешанную валентную группу, содержащую более восьми электронов. Термин смешанная валентная группа будет объяснен ниже. Перейдем к рассмотрению этих доказательств. [12]
Для Se ( ll) и Te ( II) валентные группы из 8, 10 и 12 электронов включают в каждом случае две неподеленные пары электронов. [13]
Для связей, включающих 5 - и / - орбиты и полностью поделенные валентные группы из шести или восьми электронов, получаются наиболее симметричные конфигурации из всех возможных, а именно - линейная, треугольная или тетраэдрическая. При использовании орбиты d возникают другие, менее симметричные расположения, как, например, четыре квадратные связи и шесть тригональных призматических связей. Как общее правило, если известна конфигурация связей, образованных полностью поделенными группами электронов, то можно установить расположение меньшего числа связей для тех же самых валентных групп, если принять, что неподеленные пары занимают некоторые положения связи. В редких случаях, как, например, в ионах [ SeBrep - и [ SbBr6 ] 3 -, являющихся октаэдрическими, неподеленные пары, очевидно, не оказывают влияния. [14]
Отмеченная размытость границ вторичных структурных частей системы породила проблемы так называемых переходных элементов от восьмой валентной группы к первой и структуры 7-го и 8-го периодов, которые требуют физического объяснения и адекватного отражения в системе. [15]
Страницы: 1 2 3 4