Валентная группа
Cтраница 3
Таким образом, второй период каждого этапа является, с одной стороны, продолжением, а с другой - повторением первого. На спиральной модели Системы химических элементов хорошо видна искусственность деления валентных групп на главную и побочную в табличном варианте. [31]
Si-О в орто-силикатном ионе могут иметь частично характер двойной связи. Есть некоторая вероятность, что в этих элементах второго короткого периода валентная группа может выйти за пределы октета, но положение сильно осложняется сравнительно большим ( оО; 0) ионным характером связей Si - О. Это указывает на вторую отличительную особенность кремния. Известно, что углерод не образует более четырех ковалентных связей, а ковалентность кремния может доходить до шести. Углерод не дает соединений, аналогичных кремнефторидам, содержащим ион SiFs - и являющимся устойчивыми кристаллическими солями. [32]
В ковалентных соединениях таллий не проявляет тенденции использовать для образования связей два 6 -электрона. Действительно, моноалкилпронзводныз Tl ( Alk), в которых была бы валентная группа ( 2 2), неизвестны, тогда как трпалкплы ( валентная группа 2 4) известны, и наиболее устойчивым. Эти соединения являются ионными ( [ Т1 ( СН) ] ОН - сильное основание), а в ионах [ Tl ( Alk) ] атом таллия имеет такую же внешнюю электронную структуру, как ртуть в СН - Hg - СН. В соответствии с этим рентгенографическое определение кристаллической структуры Т1 ( СН5) 1 показало, что ион [ СН - Т1 - СН. [33]
Наиболее симметричным полиэдрическим расположением пяти лигандов является тригональная бипира-мида, которая найдена в нескольких ионных кристаллах, в некоторых ионах и молекулах, образованных непереходными элементами ( см. 40-электронная группа в разд. Близкое к этому расположение пяти лигандов по квадратной пирамиде должно быть свойственно непереходным элементам, имеющим 42-электрон-ную валентную группу, которая включает неподеленную пару ( разд. Кроме того, по структуре некоторые комплексы переходных металлов ( они описаны в соответствующих разделах) ближе к квадратной пирамиде, чем к тригональной бипи-рамиде. [34]
Интересный изоэлектронный ряд составляют CN, N2, NO, CO. Молекулы азота и окиси углерода обладают весьма сходными физическими свойствами, вероятно потому, что при идентичных валентных группах силовые поля вокруг этих молекул практически одинаковые. [35]
 |
Схема распре - [ IMAGE ] Схема строения ме. [36] |
Наибольшее влияние на свойства элементов оказывают электроны внешней орбиты. Их число на орбите может быть различно ( от 0 до 8) в соответствии с положением элемента в валентной группе таблицы Менделеева. [37]
Хотя SnO и РЬО имеют одинаковые кристаллические структуры, SnS обладает структурой, совершенно отличной от структуры PbS. Вместо правильного октаэдрического окружения атом олова имеет три соседних атома серы, расположенных приблизительно на равных расстояниях, и поэтому с валентной группой 2 6 он образует три пирамидальных связи. Сравнение дигалоге-нидов олова и свинца невозможно, так как структуры кристаллических дигалогенидов олова еще неизвестны. [38]
В ковалентных соединениях таллий не проявляет тенденции использовать для образования связей два 6 -электрона. Действительно, моноалкилпронзводныз Tl ( Alk), в которых была бы валентная группа ( 2 2), неизвестны, тогда как трпалкплы ( валентная группа 2 4) известны, и наиболее устойчивым. Эти соединения являются ионными ( [ Т1 ( СН) ] ОН - сильное основание), а в ионах [ Tl ( Alk) ] атом таллия имеет такую же внешнюю электронную структуру, как ртуть в СН - Hg - СН. В соответствии с этим рентгенографическое определение кристаллической структуры Т1 ( СН5) 1 показало, что ион [ СН - Т1 - СН. [39]
Алкилаты ( например, ТЮС2Н5) существуют в бензольном растворе в виде учетверенных молекул, как это доказано спределением молекулярных весов. Структура такой сложной молекулы схематически изображена выше. В этой молекуле валентная группа таллия должна быть составлена ив электронов ( 2 6); следует отметить, что необходима дальнейшее изучение этих соединений. [40]
Из табл. 3 видно, что химические элементы в ней Менделеев разместил по 19-ти горизонтальным и шести вертикальным столбцам. Причем какие-либо наметки на валентные группы у него отсутствуют. Примерно то же самое мы видим и у его предшественников. [41]
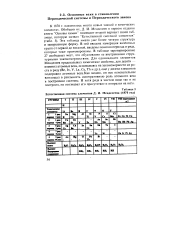 |
Естественная система элементов Д. И. Менделеева ( 1870 год. [42] |
В ней введена нумерация валентных групп от первой до восьмой, введены понятия периода и ряда, которые тоже пронумерованы. В таблице зарезервировано 27 свободных мест, что обусловлено ее внутренними структурными закономерностями. Для одиннадцати элементов Менделеев предсказывал химические свойства, для десяти - изменил атомные веса, основываясь на закономерности их роста в ряду ( Be, In, V, La, Ce, Th и др.), еще у десяти элементов подправил атомные веса. Как видим, он все основательнее воплощал в реальность интегративную роль атомного веса в построении системы. [43]
Ниже мы рассмотрим строение соединений ксенона без особого углубления в их стереохимию. Взаимное расположение связей большей частью отвечает простым соотношениям стереохимии непереходных элементов, изложенных в гл. Очевидно также, что осложнения, возникающие при наличии определенных валентных групп в стереохимии сурьмы, теллура и иода, обнаруживаются и здесь. [44]
Но следует отметить, что по мере роста номера изопро-тонного ряда ( химического элемента) не только идет увеличение общего числа электронов в электронной оболочке атома, но и усложняется ее структура. В частности, растет число квантовых подслоев в электронном слое, что вносит новые структурные элементы в модель системы. Например, подразделение химических элементов по химическим свойствам на VIII валентных групп уже не отражает все особенности структуры электронной оболочки и вызванные этим особенности химических свойств. Чтобы показать их наглядно, валентные группы ( сектора на модели), в свою очередь, поделены на подсектора, которые идентифицируются с s -, p -, d -, f - семействами атомов. [45]
Страницы: 1 2 3 4