Ацетамидная группа
Cтраница 2
Полиимиды с концевыми фенильными или двумя ангидридными группами обладают более высокой стойкостью к тсрмоокислителыюй деструкции, чем полимеры с концевыми амндными или ацетамидными группами. [16]
В рассматриваемом далее методе [3] используются, следующие реакции: мезилирование легко доступного бензил-2 - ацетимидо-4 6 - О-бензил-иден - 2-дезокси-а - о-глюкопиранозида ( I) [4] приводит к эфиру II, который далее по известной реакции [5], протекающей с участием соседней ацетамидной группы, превращается в производное аллозы III; после повторного мезилирования метилсульфонилоксигруппу эфира IV замещают на азидную. [17]
Хитин, или поли - ( М - ацетил - О-глюкозамин), является ( 1 - - 4) - 3-полимером, который химически отличается от целлюлозы только тем, что гидроксильная группа у атома С2) каждого звена замещена на ацетамидную группу. QD, содержащего альдегидную группу, отличается от последовательности атомов в противоположном направлении от спиртового атома С ( 4), так что соседние цепи могут быть параллельными или антипараллельными. Эта полярность молекулярной цепи отличается от полярности, связанной с направлением закручивания в микрофибриллах целлюлозы I; микрофибриллы бактериальной целлюлозы образуют левую спираль с шагом 1 мкм. [18]
Константа скорости катализируемого лизоцимом гидролиза п-нитрофенил-2 - ацетамидо-4 - О - ( 2-ацетамидо - 2-дезокси - ( 3-п-глюкопиранозил) - 2-дезоксиглюкопиранозида в 20 раз выше, чем в случае п-нитрофенил-4 - О - ( 2-ацетамидо - 2-дезокси - 3-о-глюкопи - ранозил) - ( 3 - 0-глюкопиранозида [16], что указывает на важную роль ацетамидной группы. [19]
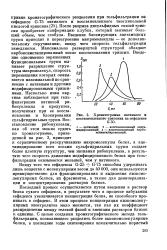 |
Хроматограмма нативного и. [20] |
После разрыва дисульфидных связей трипсин приобретает конформацию клубка, который занимает больший объем, чем глобула. Введение блокирующих ацетамидных групп приводит к перестроению макромолекулы - ее дополнительному скручиванию, ввиду чего скорость гельфильтрации замедляется. Максимально развернутой структурой обладает карбоксиметилированный после восстановления трипсин. Введение одноименно заряженных функциональных групп вызывает разрыхление структуры макромолекул скорость перемещения которых оказывается максимальной по сравнению с нативным и другими модифицированными трипсинами. Несколько иная картина наблюдается при гель-фильтрации нативной ри-бонуклеазы и продуктов, полученных при ее восстановлении и блокировании сульфгидрильных групп. [21]
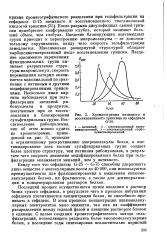 |
Хроматограмма нативного и. [22] |
После разрыва дисульфидных связей трипсин приобретает конформацию клубка, который занимает больший объем, чем - глобула. Введение блокирующих ацетамидных групп приводит к перестроению макромолекулы - ее дополнительному скручиванию, ввиду чего скорость гельфильтрации замедляется. Максимально развернутой структурой обладает карбоксиметилированный после восстановления трипсин. Введение одноименно заряженных функциональных групп вызывает разрыхление структуры макромолекул скорость перемещения которых оказывается максимальной по сравнению с нативным и другими модифицированными трипсинами. [23]
Полностью определено его строение, в т.ч. третичная структура. Щель имеет гидрофобный карман, в к-ром локализуется ацетамидная группа 1 -ацетилглюкозамина. [24]
Изучено поведение 2-замещенных 5-ацетамидтиофенов при взаимодействии с электронами. Отмечено, что на диссоциативную ионизацию молекулярного нона основное влияние оказывает ацетамидная группа. Разрыв связи С-N и элиминирование частиц СОСН2 и СОСН3 обусловливает начальную стадию распада. Последующая фрагментация ионов ( М - СОСН3) и ( С - СОСН2) определяет весь масс-спектр исследованных тиофенов. Показано, что природа заместителя не оказывает существенного влияния на поведение рассматриваемых соединений. Отрыв заместителя или его расщепление, вызванное разрывом а - или р-связи, происходит в основном на последующих ступенях распада. [25]
Большое число примеров о-дизамещенных бензола, в которых происходит образование замещающими группами шестичленного цикла, включающего водородную связь ( см. XIX-XXVI), подтверждает предположение, что важным условием устойчивости таких циклов является их копланарность с бензольным ядром. Так, о-нитроацетанилид ( XXIX) не ассоциирован вследствие участия атома водорода его иминогруппы в образовании клешневидного цикла; однако замещение группы X в положении 6 ( XXX) приводит к повороту ацетамидной группы в наклонное положение к плоскости бензольного ядра, в результате чего водород иминогруппы становится слишком отдаленным от нитрогруппы и замыкания кольца не происходит. Поэтому такие соединения ассоциированы. [26]
Само по себе это обстоятельство еще не подтверждает нашей гипотезы, так как ацетамидная и пропионамидная группы находятся с разных сторон от плоскости кобальтикорринового ядра. Таким образом, если молекула Н2О в аквокобаламине расположена на противоположной стороне хромофора по отношению к цианиду в витамине Bi2, как считает Эйчхорн [5], то она, по-видимому, стабилизируется пропионамидной группой; так же легко ее стабилизируют ацетамидные группы, если она расположена на той же стороне. [27]
По подобной причине реакция анилина с хлорангидридоад кислоты дает амид, а не продукт замещения в кольце ( разд. Обычно с помощью этой реакции уменьшают реакционную способность анилина в электрофильном замещении. Ацетамидная группа ( CH3CONH -) обладает меньшей элек-тронодонорной способностью, чем аминогруппа, поскольку карбонильный заместитель уменьшает действенность неподеленной пары на азоте. [28]
Трудность контролируемого бромирования анилинов может быть уменьшена первоначальным ацетилированием амина; получающийся при этом ацетанилид реагирует с бромом намного медленнее, чем сам анилин. Бром - n - толуидин, например, получается бромированием n - ацетотолуидина при 50 - 55 и последующим удалением ацетильной группы гидролизом. Хотя ацетамидная группа - гораздо менее слабый ориентант, чем аминогруппа, она тем не менее способна определять положение вступающего заместителя. [29]
Это объясняется тем, что найлон, использованный для работы Эледом и Фрелихом, был получен в лаборатории конденсацией эквимолярных количеств диамина и дикарбоновой кислоты. Продажный же найлон получают из тех же компонентов, но с добавкой небольшого количества уксусной кислоты, которая обрывает растущие цепи. Такой найлон содержит примерно 0 036 эквивалента аминогрупп и 0 063 эквивалента концевых ацетамидных групп на 1 кг волокна. [30]
Страницы: 1 2 3