Дополнительная метильная группа
Cтраница 2
Полученные результаты для N-фенил -, N - n - толил-и N-бензилмальимидов могли бы в первую очередь быть интерпретированы влиянием температуры, а проведение опытов при одной температуре привело бы к неравноценности условий для твердофазной полимеризации. Поэтому весьма показательны данные для N-2, 4-диметилфенилмальимида, который отличается от N - n - толил-мальимида дополнительной метильной группой в орто-положении. Это исходя из приведенного выше должно в еще большей степени повышать его способность к полимеризации. Однако полимеризация N-2, 4-диметилфенилмальимида даже при более высокой температуре идет несравненно медленнее, чем полимеризация N-бен-зилмальимида. [16]
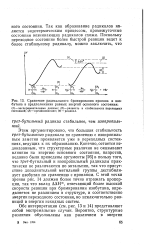 |
Сравнение радикального бромирозания пропана и изо-бутана в предположении равных энергий основного состояния. [17] |
Этим аргументировано, что большая стабильность трет-бутильного радикала по сравнению с изопропиль-ным заметно проявляется уже в переходных состояниях, ведущих к их образованию. Конечно, остается недоказанным, что структурные различия не оказывают влияния на энергию основного состояния, напротив, недавно были приведены аргументы [26] в пользу того, что грег-бутильный и изопропильный радикалы практически не различаются по энтальпии, так что присутствие дополнительной метильной группы дестабили-зует изобутан по сравнению с пропаном. С этой точки зрения рис. 14 должен более точно отражать пропорции, так что вклад ДДН, отвечающий более высокой скорости реакции при бромировании изобутана, определяется не различием в структуре, и соответственно анергии переходного состояния, но исключительно разницей в энергии исходных систем. [18]
Поэтому р-метилирование оказывает второстепенное влияние на связь углерод-галоген и не первостепенное - на связь углерод-водород, которые принимают участие в элиминировании. Это подтверждается наблюдением Стоуна [50], согласно которому при пиролизе етор-бутилхлорида образуется 40 % бутена-1. Дополнительная метильная группа повышает скорость элиминирования не только из продленной ветви, но также и из неизмененной. [19]
Поэтому р-метилирование оказывает второстепенное влияние на связь углерод-галоген и не первостепенное - на связь углерод-водород, которые принимают участие в элиминировании. Это подтверждается наблюдением Стоуна [50], согласно которому при пиролизе erop - бутилхлорида образуется 40 % бутена-1. Дополнительная метильная группа повышает скорость элиминирования не только из продленной ветви, но также и из неизмененной. [20]
Насыщенные алкильные заместители оказывают электроно-донорное действие по отношению к кр5 - углеродному атому. Поэтому дополнительные алкильные заместители понижают устойчивость кэрб - аниона, однако по-видимому, это влияние незначительно. Две дополнительные метильные группы на соседнем атоме углерода пони жают скорость отнятия протона приблизительно в 100 раз. [21]
Закономерности превращений алкилфенолов определяются также природой катализатора, как показали результаты гидрогенизации их при 350 С, атмосферном давлении в присутствии никелевого катализатора ( 8 4 вес. Скорость этих реакций существенно выше для алкильной группы, находящейся в орто-положении, и падает с увеличением длины группы от Q до С4, а разветвление ее оказывает малое влияние. С введением дополнительной метильной группы в положение 5 о-алкилфенолов o - RC6H4OH при R С2Н5, ( СНзЬСН также несколько умень шалась скорость деалкилирования и деструкции высшей алкильной группы. По мнению авторов43, при деалкилировании на никелевом катализаторе гораздо большую роль играют пространственные, а не электронные факторы. [22]
Известен также ряд других, менее непосредственных примеров того же явления. Неожиданно найдено [23], что мезитилен, дурол ( XV) и изодурол ( XVI) можно диацетилировать хлористым ацетилом в присутствии хлористого алюминия, а из ж-ксилола получается только моноацетильное производное. Едва ли это поведение обусловлено активацией за счет дополнительных метильных групп. [23]
 |
Структура аланиновой тРНК ( одна из трех вероятных структур. на отдельных участках произошло спаривание оснований. Узнающая группа ( антикодон обведена красной рамкой. [24] |
Это обозначения некоторых редко встречающихся нуклеотидов, в которые, как правило, входят незначительно измененные общеизвестные основания, уже знакомые читателю. Так, греческой буквой ф принято обозначать псевдоуридин, буква И - условное обозначение для инозина, а У - Н2 - это не что иное, как дигидроуридин - уридин, у которого на два атома водорода больше, чем обычно. Символ Me тоже вряд ли вызовет затруднения; он означает, что в молекуле имеется дополнительная метильная группа. В заключение следует еще сказать, что представленная на рис. 22 структура ( конформация) - всего лишь один из трех возможных вариантов. [25]
Ю-7 дин - сек / см. Коэффициент трения является мерой отнесенной к мономерному звену средней силы, необходимой для того, чтобы протянуть сегмент цепи с единичной скоростью через его локальное окружение. Он должен зависеть от свободного объема, межмолекулярного взаимодействия и стерических препятствий вращению вокруг простых связей. Сравнение значений для ряда метакрилатов показывает, что длинные боковые группы уменьшают трение. К указывает на заметное стерическое торможение, вызванное дополнительными метильными группами в первом полимере. [26]
Были высказаны конкретные предположения относительно химизма таких часов. Так, указывалось, что вопреки представлению о высокой стабильности ДНК это соединение легко мутирует под влиянием химических факторов. В самом деле, известно, что в ДНК содержится определенное количество дополнительных метильных групп, которыми, например, могут быть маркированы отдельные участки ( гл. [27]
Если же вместо бензойной кислоты взять ж-хлор-бензойную кислоту, то она также подвергнется окислению, но фермент, окисляющий катехин, будет неспособен окислить 3-хлоркатехин. Аналогично при выращивании видов Pseudomonas на среде, содержащей п-крезол в качестве источника углерода, не удается обнаружить n - оксибензойную кислоту. Тем не менее о превращении n - крезола в л-оксибензойную кислоту свидетельствуют следующие данные. Таким образом, ферментная система, ответственная за окисление крезола, нечувствительна к присутствию дополнительной метильной группы в молекуле исходного субстрата. [28]
Поэтому задача создания специфических рецепторов подобных соединений исключительно трудна. Тем не менее, и в этой области уже найдены эффективные решения. Наличие гидрофобной полости достаточного размера придает соединениям 226 способность комплексопаться с гидрофобными ароматическими соединениями. Четвертичные аммониевые группы на периферии молекулы придают этим моделям растворимость в воде. В ряду соединений 22ба - 226d иарьирование длины цепей позволяет управлять размерами внутренней полости, а введение дополнительных метильных групп, как в 22бе - 226Ъ, - формой полости и ее гидрофобостью. [29]
Исследование восстановления фенилпиридинов [65] показало, что 2 - и 3-фенилпиридины легко восстанавливаются водородом в присутствии окиси платины до 2 - и 3-феншшиперидинов, в то время как 4-фенилпиридин возвращается из реакции в неизмененном состоянии. Дифенилпиридин был восстановлен в тех же самых условиях до 2 6-дициклогексилпиперидина, в то время как из пентафенилпиридина образовался тетрациклогексилпи-перидин-одна молекула бензола отщепляется в результате гидрогенолиза. В общем случае производные пиридина восстанавливаются легче, чем сам пиридин, а вещества с заместителями в положении 2 обычно восстанавливаются с наибольшей легкостью. Так, например, 2-бензилпиридин восстанавливается до 2-бензилпиперидина с 96-процентным выходом при 100, в то время как для пиридина требуется температура примерно 200 с тем же самым катализатором. Изучение скоростей восстановления гомологов пиридина, проведенное М. И. Ушаковым [72, 73], показывает, что восстановление протекает легче в том случае, если в пиридиновое кольцо вводится дополнительная метильная группа; этот эффект выражен тем ярче, чем ближе к атому азота расположен заместитель. Азотистые основания сильно адсорбируются катализаторами гидрирования; возможно, что стерический эффект заместителей, смежных с атомом азота, уменьшает эту сильную адсорбцию и тем самым снижает степень отравления катализатора. [30]
Страницы: 1 2 3