Диффузия - продукт - реакция
Cтраница 2
В данном примере оба диффузионных процесса - диффузия исходного вещества и диффузия продукта реакции - происходят в растворе. [16]
Во втором слое ( между сечениями ДД и ЖЖ) происходит диффузия продукта реакции с понижением его концентрации от Ср до С и. Положение поверхности ДД, на которой протекает реакция, определяется равновесием между количествами диффундирующих газа и активной части поглотителя в соответствии со стехиометрическими соотношениями реакции. [17]
 |
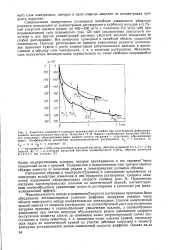
Схема ячейки для изучения стационарной диффузии при образовании амальгам и распределение концентрации ионов металла в растворе и атомов металла в амальгаме. [18] |
В данном примере оба диффузионных процесса - диффузия исходного вещества и диффузия продукта реакции - происходят в растворе. [19]
Чувствительность метода к изменению скорости растворения кристалла была обусловлена нестационарным режимом диффузии продуктов реакции череа область электролита между измерительными электродами. [21]
Уравнение (10.8) выведено исходя из предложения, что скорость коррозии определяется диффузией продуктов реакции в окружающую среду, поэтому D - это коэффициент диффузии ионов кальция из цементного камня наружу. В связи с этим в приведенном уравнении (10.8) отсутствует концентрация агрессивного агента - сероводорода, что затрудняет его использование. [22]
Скорость окисления обратно пропорциональна давлению кислорода или общему давлению, что объясняется уменьшением скорости диффузии продукта реакции ( GeO) с повышением давления. [23]
Полученные нами экспериментальные данные позволяют сделать вывод, что наиболее медленными стадиями процесса являются процессы диффузии продуктов реакции и взаимодействия на поверхности восстановителя, так как скорость процесса пропорциональна поверхности угля и обратно пропорциональна вязкости расплава, но относительно мало зависит от скорости подачи хлора. Указанные зависимости хорошо соблюдаются при хлорировании апатитового концентрата в расплавах хлоридов калия или кальция. [24]
До сих пор исследованные реакции в пленках не дают доказательства того, что скорость определяется диффузией продуктов реакции от поверхности раздела или реагирующих веществ через слой продуктов реакции. Значения б, полученные при использовании уравнения Нернста, имеют величину, близкую к толщине слоя Гельмгольца. Вне этого слоя концентрация растворенного вещества может рассматриваться равной концентрации, в объеме раствора. [25]
Если катализатор имеет пористую структуру, то добавляются еще стадии диффузии реагентов в поры катализатора и диффузии продуктов реакции в обратном направлении. [26]
Внешне-диффузионной областью называют режим протекания реакции, в границах которого скорость диффузии исходных веществ к внешней поверхности катализатора или скорость диффузии продуктов реакции от внешней поверхности катализатора оказывается значительно меньшей, чем скорости других стадий процесса. [27]
В этом случае учитывается диффузия реагентов от наружной поверхности зерна внутрь его пор, химическое превращение на внутренней поверхности пор и диффузия продуктов реакции к наружной поверхности зерна. [28]
Скорость химических реакций, протекающих в гетерогенных системах, зависит от скорости диффузии молекул к границам раздела фаз, химического взаимодействия и диффузии продуктов реакции. В большинстве случаев скорость химического взаимодействия достаточно велика по сравнению со скоростями диффузии, и вследствие этого скорость всей реакции в целом при достаточно развитой поверхности контакта фаз определяется скоростью диффузии реагентов и продуктов реакции. [29]
Диффузионной называют кинетику электрохимических реакций, скорость которых определяется скоростью диффузии разряжающихся на электроде частиц из глубины раствора к электроду либо скоростью диффузии продуктов реакции от электрода. Примером электродных процессов, лимитируемых диффузией, могут служить процессы выделения щелочных металлов на ртутном катоде, скорость которых лимитируется скоростью диффузии щелочного металла от поверхности в глубь ртутного катода. [30]
Страницы: 1 2 3 4