Дж-моль
Cтраница 3
В процессе плавления одного моля льда система поглощает теплоту плавления, равную 6010 Дж-моль - 1, и при этом температура системы не изменяется ( разд. Отсюда следует, что энтропия увеличилась на 6010 / 273 15 22 00 Дж-град - 1-мо ль-1 до величины 73 84 Дж-град - 1-моль - 1, которая и является мольной энтропией воды при О С. [31]
Рассчитайте энтропию паров воды при 100 С, если энтропия жидкой воды равна 87.0 Дж-моль - К 1 При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при 104 С. [32]
Значение PV для Н2 ( г.) равно RT, или 8 3146x298 152479 Дж-моль - 1 2 479 кДж - моль-1. Соответствующая величина для V202 ( г.) в два раза меньше и составляет 1 240 кДж - моль-1. [33]
В [22] приведено значение 5 ( г, 329 К) - 256 1 Дж-моль - 1 - Кг1, рассчитанное по спектральным и молекулярным данным для идеального газового состояния. [34]
Здесь См - молярная концентрация электролита, моль / л R - газовая постоянная ( 8 31 Дж-моль - - К 1); Т - абсолютная температура, К. [35]
Тогда отношение предэкспонен-циальных факторов прямой и обратной стадий процесса (6.1) дает значение энтропии реакции, равное 50 4 Дж-моль 1 - Кг1, что более чем на 20 2 Дж-моль 1 - К 1 меньше значения, получаемого из термодинамических данных. Между тем погрешность в определении энтропии радикала - СН3 столь мала, что расхождение в константах скорости реакции (6.1) нельзя, по-видимому, объяснить на основе энтропийных факторов. [36]
Здесь См - молярная концентрация электролита, моль / л; R - газовая постоянная ( 8 31 Дж-моль - - К 1); Т - абсолютная температура, К. [37]
Погрешность значений A / / s составляет 40 Дж-моль - 1 для ароматических ( более растворимых) соединений и 150 Дж-моль - 1 для алифатических. Соответствующие значения для AS 0 3 и 0 8 Дж моль-1 Кг1 - Погрешности значений ACps указаны в таблице. Полные данные калориметрических измерений даны в Приложениях. [38]
Почти все они обладают высокой энергией, достигающей 109 эВ на 1 ядро ( 1 эВ 1 602 - Ю-19 Дж) или 9 65 - 1013 Дж-моль -, и движутся со скоростью, близкой к скорости света. [39]
Если переход при Тс не сопровождается изменением энтальпии, то должно соблюдаться соотношение Hsc ( О К) - Н ( О К) - 0 30 Дж-моль 1; отсюда следует, что сверхпроводящее состояние при О К. [40]
Учитывая отрицательные значения Д S, полученные для реакций образования ионных пар К IrClff и Ва2 - 1гС1 -, равные - 25 [144] и - 24 Дж-моль 1 - К 1 [ 152, вторая ссылка ], можно предполагать, что тормозящие реакцию акватации катионы первой группы образуют с 1гС1 Г лишь неконтактные ионные пары, в которых остается прослойка молекул воды, разделяющая взаимодействующие ионы, либо неконтактные ионные пары преобладают в растворе. Входящий в состав ионной пары Mz - IrCl - внешнесферный катион будет способствовать замещению на воду наиболее близких к нему внутрисферных хлор-ионов, электростатически притягивая их. Однако, молекулы воды, непосредственно соприкасающиеся с комплексом IrClg, под влиянием поля ионной пары будут ориентироваться к нему атомами водорода, что невыгодно для образования переходного состояния при наиболее вероятном диссоциативном механизме взаимного обмена. [41]
Поступательный вклад в энтропию водорода при некоторых условиях равен 108.0 Дж Моль - - К -, а в энтропию неизвестного газа при этих же условиях - 147.1 Дж-моль - - К Определите неизвестный газ. [42]
Тогда отношение предэкспонен-циальных факторов прямой и обратной стадий процесса (6.1) дает значение энтропии реакции, равное 50 4 Дж-моль 1 - Кг1, что более чем на 20 2 Дж-моль 1 - К 1 меньше значения, получаемого из термодинамических данных. Между тем погрешность в определении энтропии радикала - СН3 столь мала, что расхождение в константах скорости реакции (6.1) нельзя, по-видимому, объяснить на основе энтропийных факторов. [43]
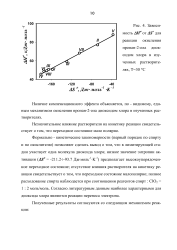 |
Зависимость АН от AS для. [44] |
Формально - кинетические закономерности ( первый порядок по спирту и по окислителю) позволяют сделать вывод о том, что в лимитирующей стадии участвует одна молекула диоксида хлора; низкое значение энтропии активации ( AS - 211.2 - 93.7 Дж-моль - К 1) предполагает высокоупорядоченное переходное состояние; отсутствие влияния растворителя на кинетику реакции свидетельствует о том, что переходное состояние малополярно; полное расходование спирта наблюдается при соотношении реагентов спирт: С1О2 1: 2 моль / моль. Согласно литературным данным наиболее характерными для диоксида хлора являются реакции переноса электрона. [45]
Страницы: 1 2 3 4