Двуокись
Cтраница 1
 |
Схема экспериментальной протбчной установки для приготовления калиброванных смесей диметиламина с кислородом. [1] |
Двуокись и окись углерода, а также другие неорганические вещества определению не мешают. [2]
Двуокись WO2 имеет в анализе второстепенное значение. [3]
Двуокись гафния ведет себя аналогично двуокиси циркония. [4]
Двуокиси ( называемые также перекисями) свинца, марганца и им подобные ( доп. [5]
Двуокись получают обжигом серного колчедана FeS2 или серы. Источником двуокиси серы могут служить и отходящие газы предприятий цветной металлургии. Окисление сернистого газа проводят при 440 - 470 в присутствии катализатора. [6]
Двуокись гафния НЮ2 имеет температуру плавления около 2770 С. По своей химической природе она сходна с двуокисью циркония, которой обычно сопутствует. Имеет аналогичную полиморфную разновидность ( при 1700 - 1800е С) и стабилизируется подобно двуокиси циркония. Этот природный недостаток двуокиси гафния, а также высокая стоимость и дефицитность ее не дают возможности считать ее перспективным материалом для получения керамики чистых окислов. [7]
Двуокись и трехокись серы - основные окислы серы, присутствующие в атмосфере. Двуокись серы - негорючий, невзрывающийся, бесцветный газ, который ощущается на вкус при концентрациях в воздухе от 0 3 до 1 0 млн-1. При концентрациях выше 3 0 млн 1 газ имеет острый раздражающий запах. В фотохимических и каталитических процессах в атмосфере двуокись серы частично превращается в трехокись серы или серную кислоту и ее соли. Трехокись серы во влажном воздухе образует серную кислоту. Для окислов серы в комбинации со взвешенными частицами и влагой характерны наиболее вредные воздействия из создаваемых загрязненным воздухом. К сожалению, исключительно трудно выделить изолированно воздействие двуокиси серы. Более подробно обсуждение воздействия серусодержащих соединений будет проведено в последующих разделах. [8]
Двуокиси Sn02 и РЬО2 кристаллизуются в структуре рутила и должны рассматриваться преимущественно как кристаллы. Свинец не образует дисульфида, a SnS2 имеет слоистую структуру йодистого кадмия, в которой атомы олова имеют шесть октаэдрически расположенных соседних атомов серы. [9]
Двуокись - глушитель эмалей, придает им белый цвет и непрозрачность. Эмали с 4 % ZrO2 высокостойки против действия растворов и щелочей при повышенной температуре. Используется в производстве высококачественных оптических, термостойких, химически стойких стекол и хрусталя. Применяется в производстве радиокерамики. [10]
Двуокись МпО2, тетрагидроксид Мп ( ОН) 4 обладают амфотер-ными свойствами. [11]
Двуокись гафния с Z500 - 1380 А начинает реагировать с Ln203 при 1100 С. Начало, взаимодействия двуокиси гафния с D 10 000 - 20 000 А с Nd203 и Sm203 наблюдается только при 1200 С, а с Dy203 - даже при 1300 С. [12]
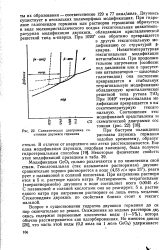 |
Схематическая диаграмма стояния двуокиси германия. [13] |
Двуокись существует в нескольких полиморфных модификациях. При гидролизе галогенидов германия или растворов германатов образуется в виде мелкокристаллического осадка гексагональная низкотемпературная модификация двуокиси, обладающая кристаллической решеткой типа а-кварца. [14]
Двуокись ТаО2 ( или Та2О4), по данным некоторых исследователей, образуется на аноде при разложении воды электролизом, если анодом служит металлический тантал. [15]
Страницы: 1 2 3 4