Двуокись - германий
Cтраница 2
Двуокись германия обладает кумулятивным действием. Так, при длительном приеме с водой токсическая доза для белых мышей составляет 17 мг-кг 1 в сутки ( смертность в первые 4 недели - 50 / о) а при приеме с пищей - 90 мг-ке 1 в сутки. [16]
Двуокись германия, как известно, получают гидролизом из очищенного дистилляцией тетрахлорида германия, водород подвергают тщательной очистке. [17]
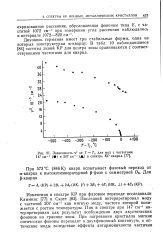 |
Зависимость v2 от Т - Тс для мод с частотами 147 см-1 ( и 207 см-1 ( А в спектре КР кварца. [18] |
Двуокись германия имеет три стабильные формы, одна из которых изоструктурна а-кварцу. В табл. 10 наблюдавшиеся [84] частоты линий КР для центра зоны сравниваются с соответствующими частотами для кварца. [19]
Двуокись германия, как компонент силикатных стекол, не нашла применения, хотя и является хорошим стеклообразовате-лем. [20]
Двуокись германия в водных растворах реагирует с простыми дифенолами, образуя два ряда комплексных соединений: малорастворимые комплексы GeO2 - 2H2O, так называемые гер-манийдифенолы, и растворимые комплексы ЬЬОеФз, так называемые фенолгерманиевые кислоты. [21]
Двуокись германия GeO2 - амфотерный окисел, представляет собой белый порошок, растворимый в кислотах с образованием соответствующих солей. В воде заметно растворяется, образуя германиевую кислоту Ge ( OH) 4; эта кислота в чистом виде не выделена, но соли ее - германаты - известны. [22]
Двуокись германия GeO2 применяют для изготовления некоторых сортов оптического стекла с высоким коэффициентом преломления. [23]
Двуокись германия, в отличие от двуокиси кремния, заметно растворима в воде. При 20 С растворимость составляет 0 4 %, при 100 С - около 0 95 %, Двуокись германия раство-ряется в щелочах с образованием германатов. Германаты щелочных металлов растворимы в воде, германаты щелочноземельных и тяжелых металлов малорастворимы в воде, но легко разлагаются кислотами. [24]
Двуокись германия служит основным исходным соединением для производства германия. [25]
Двуокись германия GeO2 получается при сжигании тонкоизмельченного германия в кислороде при температурах порядка 800 С или гидролизом тетрахлорида германия. Двуокись германия плавится при 1115 С, а при охлаждении образует стекловидную массу, которая довольно легко кристаллизуется. При температурах, превышающих 1250 С, двуокись германия довольно быстро испаряется. [26]
Двуокись германия загружается в графитовую лодочку и помещается в кварцевую трубу, через которую проходит поток чистого водорода. Восстановление производится при 650 С; по-лученный порошкообразный германий постепенно нагревается до расплавления, после чего осуществляется его направленная кристаллизация. При тщательном проведении всех начальных операций 5 - 10 проходов расплавленной зоны оказываются достаточными, чтобы получить материал такой чистоты, когда добавочные проходы не изменяют его физических свойств. Отметим еще раз, что эффективность зонной очистки и ее оценка по физическим свойствам являются однозначными, только если в течение всего процесса слиток остается монокристалличным. [27]
Двуокись германия обладает слабыми кислотными и еще более слабыми основными свойствами. [28]
Двуокись германия можно восстановить алюминием, магнием, углеродом до металлического германия; для этого требуется нагревание. [29]
Двуокись германия применяют для получения оптических стекол, так как при частичном замещении Si02 на Ge02 получаются очень прозрачные, сильно преломляющие стекла; однако они более растворимы и более хрупки, чем обычные стекла. [30]
Страницы: 1 2 3 4