Деацилирование
Cтраница 3
ЕА - ацилферментное промежуточное соединение, образованное в результате ацилирования активного центра фермента молекулой субстрата; PI и Р2 - продукты реакции, образованные на стадиях ацилирования и деацилирования соответственно; k2 и k3 - индивидуальные константы скоростей реакций ацилирования и деацилирования. Если фермент-субстратный комплекс ES находится в квазиравновесном состоянии с исходным субстратом и ферментом, то Ks называется истинной константой Михаэлиса. [31]
ЕА - ацилферментное промежуточное соединение, образованное в результате ацилирования активного центра фермента молекулой субстрата; PI и Рг - продукты реакции, образованные на стадиях ацилирования и деацилирования соответственно; k2 и &3 - индивидуальные константы скоростей реакций ацилирования и деацилирования. Если фермент-субстратный комплекс ES находится в квазиравновесном состоянии с исходным субстратом и ферментом, то Ks называется истинной константой Михаэлиса. [32]
Алкилэфиры а-нафталинтиосульфокислоты ( II, при Аг 1 - С 0 Н7) проявляют несколько более высокую противобактериальную активность, чем аналогичные эфиры бензолтиосульфокислоты; алкилэфиры ацетилтио-нафтионовой кислоты ( II, при Аг 4 - CH3CONHC10H6) более активно действуют на испытанные виды бактерий и менее активны по отношению к грибам, чем аналогичные эфиры бензольного ряда, а эфиры тиопурпури-новой кислоты ( II, при Аг 5 - NH2C ] 0H0) отличаются еще более слабым действием на те же бактерии и особенно грибы. Деацилирование эфиров ацетилтионафтионовой кислоты почти не сказывается на активности полученных при этом соединений и даже уменьшает ее по отношению к Mycobacterium В5, хотя фунгицидные свойства эфиров тионафтионовой кислоты несколько выше, чем ацилированных продуктов. [33]
Основное различие заключается в том, что наличие ацетамидной группы приводит к выигрышу в энтропии активации. Константы скорости деацилирования ацилферментов с а-ацетамидной группой характеризуются меньшей отрицательной энтропией активации на величину 10 - 12 кал-моль-1 - град 1, при этом стабилизация переходного состояния ацилферментов с а-ацетамидной группой имеет чисто энтропийную природу. Взаимодействие между ацетамидной труп - Л пой и активным центром ориентиру - Д ет и замораживает гидролизуе - мую сложноэфирную связь в по - 5 ложении, обеспечивающем реакци - онноспособное состояние активного центра. [35]
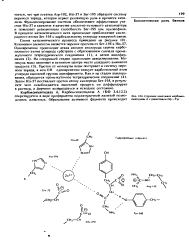 |
Строение комплекса карбоквн - пептидазь А с дипегтидом Gly-Туг. [36] |
Ключевым элементом является перенос протона от Ser-195 к His-57. На следующей стадии происходит деацилирование. Протон от молекулы воды поступает в систему переноса заряда, а ион ОН одновременно атакует карбонильный атом углерода ацильной группы ацилфермента. Затем His-57 поставляет протон атому кислорода Ser-195, в результате чего освобождается ацильный продукт; ои диффундирует в раствор, а фермент возвращается в исходное состояние. [37]
К и К включает щелочное деацилирование прир. [38]
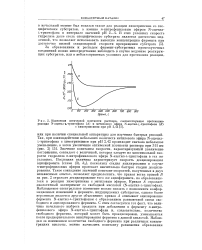 |
Изменение оптической плотности раствора, соответствующее протеканию реакции К-ацетил-ь - триптофана ( А и метилового эфира К-ацетил-ь - триптофана ( В. [39] |
Значение константы скорости, характеризующей увеличение поглощения, совпадает с величиной, которая следует из максимальной скорости гидролиза тг-нитрофенилового эфира М - ацетил-ь-триптофана в тех же условиях. Последняя величина характеризует скорость деацилирования ацилфермента [ схема ( 3), k3 ], поскольку стадия ацилирования в случае тг-нитрофениловых эфиров протекает значительно быстрее стадии деацилирования. Такое совпадение значений констант скоростей, полученных в двух независимых опытах, позволяет предположить, что правая ветвь кривой Б на рис. 2 отражает деацилирование того же ацилфермента, но образовавшегося в реакции химотрипсина с метиловым эфиром. Наблюдаемое спектральное изменение можно связать с появлением конфор-мационных изменений в ферменте, индуцируемых субстратом, однако более вероятным является другое объяснение: кривая А описывает ацилирование фермента N-ацетил-ь - триптофаном с образованием равновесной смеси свободного и ацилированного фермента. С этим согласуется тот факт, что величина начального выброса продукта при добавлении к ферменту тг-нитрофенилового эфира 1Ч - ацетил-ь-триптофана и, следовательно, количество свободного фермента, который может быть проацилирован, уменьшаются после предварительного инкубирования фермента с данной кислотой. [40]
В продуктах щелочного гидролиза моногликозилдиглицеридов были обнаружены жирные кислоты ( 2 моль на 1 моль липида) и 3 - O - p - D-галактопиранозил - 5п - глицерин. В результате исчерпывающего метилирования и последующего щелочного деацилирования был получен тет-раметилгалактозилглицерин, кислотный гидролиз которого привел к образованию глицерина и 2 3 4 6-тетра - О-метилгалактозы. При окислении этого соединения периодной кислотой образуется соответствующий альдегид. [41]
Образовавшийся ГТФ отдает свою концевую фосфатную группу АДФ с образованием АТФ. Синтез АТФ, сопряженный с деацилированием сукцинил - S-KoA, называют фосфорилированием на уровне субстрата. [42]
Обратную реакцию гидролиза сложных эфиров осуществляют нагреванием в щелочном растворе. При неравноценности гидроксигрупп в молекуле ацилирование и4 деацилирование удается провести селективно. Для защиты гидроксигрупп и для избирательного расщепления алкоксигрупп в орто - и пери - ЕОЛО-жениях к карбонильной группе используют образование хелат-ных борных комплексов. [43]
Проведенное рассмотрение показывает, что даже такой плохо реагирующий субстрат, каким является карбоксилат-ион, может реагировать с ферментом в виде более реакционной свободной кислоты, образуя ацилфермент. Гораздо большие спектральные изменения при ацилировании и деацилировании обнаруживают менее специфические субстраты типа производных цинна-моила, фуроила или бензоила, которые также реагируют с химотрипсином, образуя ацилфермент. [44]
В связи с этим главный вопрос относительно предполагаемого ферментативного механизма действия карбоксипептидазы А состоит в стерической возможности и способности карбоксильной группы Glu-270 эффективно участвовать в нуклеофильной реакции. Более того, результаты свидетельствуют о том, что деацилирование промежуточного смешанного ангидрида катализируется связанной с цинком группой. [45]
Страницы: 1 2 3 4
