N-гликозид
Cтраница 2
С-гликозида; и наконец, очень распространены в природе различные варианты образования N-гликозидов в ходе замещения полуацетального гид-роксила моносахаров азотистыми основаниями разного типа. [16]
Макроэргические соединения - аденозинтрифосфорная кислота, уридинтрифосфорная кислота и другие также построены по типу N-гликозидов. [17]
Подобно ряду производных пиримидина ( урацилу и др.) аденик встречается в природе в виде N-гликозидов рибозы и дезоксирибозы - нуклеозидов ( стр. [18]
Подобно ряду производных пиримидина ( урацилу и др.) аденин встречается в природе в виде N-гликозидов рибозы и дезоксирибозы - нуклео-зидов ( стр. [19]
Ранними исследованиями Левина и его сотрудников [9] было установлено, что нуклеозиды относятся к числу циклических N-гликозидов и не обладают редуцирующей способностью до тех нор, пока в результате гидролиза не выделится свободный сахар. Следовательно, пиримидино-вьте нуклеозиды являются N-1 - гликозидами. [20]
D-глюкозамин - гидролизом хитина), а также синтетически, действием аммиака на апгидро-сахара, перегруппировкой N-гликозидов и др. способами. [21]
D-глюкозамин - гидролизом хитина), а также синтетически, действием аммиака на ангидро-сахара, перегруппировкой N-гликозидов и др. способами. [22]
Подобно ряду производных пиримидина ( урацилу, цитозину и тимину), аденин встречается в природе в виде N-гликозидов рибозы и дезоксирибо-зы - нуклеозидов ( стр. [23]
Подобно ряду производных пиримидина ( урацилу, цитозину и тимину), аденин встречается в природе в виде N-гликозидов рибозы и дезоксири-бозы - нуклеозидов ( стр. [24]
За исключением особого случая псевдоуридина ( гликозидная связь которого образована этиленовым атомом углерода), для природных нуклеозидов ( N-гликозидов) не было получено убедительных фактов о наличии мутаротации. [25]
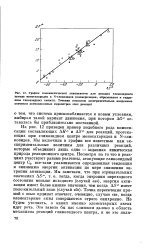
На рис. 12 приведен пример подобного рода компенсации составляющих Д / / и А5 для реакций, протекающих при гликозидном центре моносахаридов и N-гликозидов. Мы включили в график все известные нам экспериментальные величины для различных реакций, которые объединяет лишь одно - заданная химическая природа реакционного центра. Несмотря на то что в реакциях участвуют разные реагенты, атакующие гликозидный центр GI, все-таки улавливается определенная тенденция к снижению энергии активации по мере снижения энтропии активации. Точка пересечения прямой с осью ординат отвечает, очевидно, случаю в, когда элементарные акты совершаются строго синхронно. Не будем уточнять, о каких именно элементарных актах идет речь. [27]
Во втором издании полнее представлены и другие методы химии углеводов: способы получения разнообразных мер-капталей и аль-форм, ацилирования и дезацилирования Сахаров, образования эфиров минеральных кислот, О - и N-гликозидов. Добавлен ряд задач, связанных с получением гетероциклических производных углеводов, в частности, С-гликозидов фурана, пурина, птеридина, гармана, барбитуровой кислоты. [28]
Во втором издании полнее представлены и другие методы химии углеводов: способы получения разнообразных мер -, капталей и аль-форм, ацилирования и дезацилировани5Г Сахаров, образования эфиров минеральных кислот, О - и N-гликозидов. Добавлен ряд задач, связанных с получением гетероциклических производных углеводов, в частности, С-гликозидов фурана, пурина, птеридина, гармана, барбитуровой кислоты. [29]
Механизм образования N-гликози-дов этого ряда может быть объяснен, основываясь на следующих предпосылках: как правило, моносахара в водных растворах предпочтительно существуют в а-форме; во-вторых, все нуклеозиды при этом имеют ( З - конфигурацию; и, наконец, поскольку образование N-гликозида - это процесс нуклео-фильного замещения, из двух тауто-мерных форм всех нуклеиновых оснований нуклеофильными свойствами обладают их лактимные формы. [30]
Страницы: 1 2 3 4