Pt-электрод
Cтраница 3
 |
Катодные и анодные поляризационные кривые, полученные с Pt-электродом при 25 С в растворе х М PtCIf, 5 1 ( Г3 М PtCl -, 1 М NaCl, 3 М H2SO4. [31] |
Обратимые предшествующие химические реакции наблюдаются на гладком Pt-электроде при перезарядке комплексов платины в системах Pt PtCl -, PtClf [ 116, первая ссылка; 262, 328 ] и Pt PtBrg, PtBr - [ 117; 262, вторая ссылка ] в области двоинослоиного участка кривой заряжения. [32]
Таким образом, на поверхности Pt / Pt-электрода в растворах изучаемых веществ протекает реакция типа известной реакции Кан-ницарро. [33]
Кривые смещения потенциала после введения Pt / Pt-электрода в контакт с метаном в кислых растворах как по форме, так и по характеру их зависимости от рН, парциального давления СН4 и температуры аналогичны соответствующим кривым для метанола при невысоких концентрациях последнего. Значения потенциалов, которые достигаются в присутствии метана на Pt / Pt-электроде, платине Ренея, платине Адамса и платиновой черни, близки между собой и составляют при 80 С - 170 10 мв. [34]
Из работы [237] следует, что показания Pt-электрода остаются аналитически значимыми вплоть до Ci2 3 - W7 М, но здесь уже влияние кислорода и перемешивания раствора заметны. [35]
Гипохлорит-ион амперометрически титруют иодидом калия с двумя Pt-электродами. На электроды накладывают напряжение 200 - 400 мв. [36]
Самогидрирование же предельных спиртов нэ Pt / Pt-электроде при комнатной температуре нами, по-видимому, обнаружено впервые. [37]
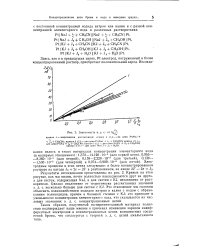 |
Зависимость э. д. с. от lg - . [38] |
Здесь, как и в предыдущих цепях, Pt-электрод, погруженный в более концентрированный раствор, приобретает положительный заряд. [39]
Нитрит-ионы можно определять в присутствии нитрат-ионов вольтамперометрически с применением Pt-электрода. [40]
ТЭ, как правило, индицируют по скачку потенциала Pt-электрода и только в работе [599] используют электрод из амальгамированного серебра. Все перечисленные методы неспецифичны и рассчитаны на определение ряда окислителей, но по показателям правильности и чувствительности наилучшей оценки заслуживают методы [466, 841], являющиеся к тому же очень простыми. [41]
 |
Схема опыта для ров. [42] |
Изменим теперь условия опыта так, чтобы один из Pt-электродов находился в контакте с раствором, в котором одновременно присутствуют компоненты обеих редокс-систем в тех же концентрациях, что и в предыдущем эксперименте. Так как компоненты систем практически не взаимодействуют, остается единственный путь переноса электронов - через Pt-электрод. Тогда, несмотря на различия в условиях проведения опытов, второй случай не будет отличаться от первого и для него остается справедливой схема. См соответствуют тем, что можно рассчитать на основе кинетических параметров электродных процессов каждой из систем, то это и есть пример реализации принципа независимости параллельных реакций на электроде и, как уже отмечалось, справедливость этого принципа была показана экспериментально. [43]
Поверхностные кислородные соединения, обогащенные О18, предварительно создавали на Pt-электроде электролизом в водном растворе H2S04, обогащенном тяжелым кислородом; затем масс-спектрометрически определяли наличие О18 в первых порциях выделяемого электрохимически кислорода из обычного ( пе обогащенного О18) раствора. Результаты опытов приведены в таблице. [44]
Как было показано в работе [20], на Pt / Pt-электроде протекают реакции дегидрирования и гидрирования НСООН при адсорбции, что может привести к образованию частиц НСО и СООН на поверхности. [45]
Страницы: 1 2 3 4 5