Дефицит - электронная плотность
Cтраница 3
В этом случае реакционная способность галогена повышается в результате увеличения дефицита электронной плотности на атакуемом атоме углерода. [31]
В щелочной среде электрофильная реакционная способность формальдегида определяется только наличием дефицита электронной плотности на атоме углерода его карбонильной группы, поэтому в реакцию гидроксиметилнровання вступает меньшее число ароматических соединении, чем в реакцию хлорметнлирования. Так, в реакцию хлорметилировання помимо фенола и его эфиров вступают бензол и его гомологи и даже хлорбензол, тогда как реакцию гидроксиметилирования удается осуществить только в случае анилина и JV. JV - дна л кил-анилинов, фенола и его эфиров. [32]
В этом случае реакционная способность галогена повышается в результат увеличения дефицита электронной плотности на атакуемом атоме углерода. [33]
В арилгалогенидах наличие - / - эффекта приводит к возникновению дефицита электронной плотности бензольного кольца, что сказывается в понижении их реакционной способности в реакциях электрофильного замещения по сравнению с бензолом. Под влиянием - / - эффекта в большей степени обедненными электронной плотностью должны оказаться орто - и пара-положения и электрофильные реагенты должны атаковать мета-положения, где дефицит электронной плотности меньше. Однако кроме сильного - / - эффекта атомы галогенов обладают также М - эффектом, обусловленным наличием неподеленных пар р-электронов. Этот эффект сравнительно невелик, но он обнаруживается в галогенбензолах даже в стационарном состоянии молекулы. [34]
В арилгалогенидах наличие - / - эффекта приводит к возникновению дефицита электронной плотности бензольного кольца, что сказывается в понижении их реакционной способности в реакциях электрофильного замещения по сравнению с бензолом. Под влиянием - / - эффекта в большей степени обедненными электронной плотностью должны оказаться орто - и пара-положения и электрофильные реагенты должны атаковать мета-положения, где дефицит электронной плотности меньше. [35]
Магнийорганические соединения реагируют как нуклеофилы и с веществами, у которых дефицит электронной плотности находится не на атоме углерода, а на атомах других элементов. [36]
В молекуле хлористого кротила вследствие передаваемого по индукции - I-эффекта атома-галоида дефицит электронной плотности возникает не только на атоме Сь непосредственно связанном с галоидом, но и в результате легкой поляризуемости связи С С на атоме Сз, входящем в винильную группу. [37]
Магнийорганические соединения реагируют как нуклеофилы и с веществами, у которых дефицит электронной плотности находится не на атоме углерода, а на атомах других элементов. [38]
Эти заместители оттягивают на себя л-электронную плотность бензольного кольца, причем наибольший дефицит электронной плотности создается в орто - и пара-положениях, поэтому в продуктах реакций электрофильного замещения преобладают лгега-изомеры. [39]
Этим можно объяснить, почему а, 3-непредельные альдегиды, у которых дефицит электронной плотности на атоме углерода карбонильной группы больше, чем на р-атоме углерода, реагируют с магнийорганическими соединениями только по карбонильной группе. [40]
При введении групп с - / - и - М - эффектами наибольший дефицит электронной плотности возникает в орто - и пара-положениях. Поэтому электрофильный реагент предпочтительно атакует жега-положение. [41]
При введении групп с - / - и - М - эффектами наибольший дефицит электронной плотности возникает в орго - и шро-поло-жениях. [42]
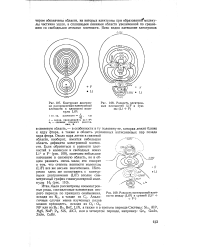 |
Контурная диаграмма распределения электронной плотности в плоскости молекулы LiF.| Разность электронных плотностей LiF и суммы ( Li F.| Разность электронной плот. [43] |
Около ядра лития в связевой области, наоборот, имеется небольшая область дефицита электронной плотности. Если обратиться к разности плотностей в молекуле и свободных ионах Li и F - ( рис. 109), замечаем небольшое натекание в связевую область, но в общем разность очень мала; это говорит о том, что степень ионности молекулы ( LiF) все же весьма значительна. [44]
Следствием этого является упрочение связи группы CsN с мети-леновой группой и уменьшение дефицита электронной плотности на входящем в нее атоме углерода. Это затрудняет нуклеофильное замещение группы CN в соединениях такого типа. [45]
Страницы: 1 2 3 4