Дефицит - электрон
Cтраница 2
Соединения с дефицитом электронов являются акцепторами электронов. Поэтому, например, при взаимодействии В2Н6 с калием за счет электронев последнего происходит образование бораната калия K BgHe, в результате чего все связи становятся двухэлектронными. [16]
 |
Зависимость содержания бутана ( 1 и. [17] |
Атом с дефицитом электронов перетягивает электронную пару по связи в р-положении, в результате чего происходит разрыв по этой связи с образованием а-олефина и карбоний-иона меньших размеров. [18]
 |
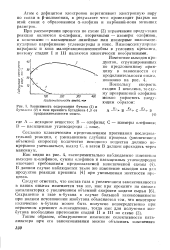
Схема образования связей В - Н - В. [19] |
Соединения с дефицитом электронов являются акцепторами электронов. Поэтому, например, при взаимодействии В2Н6 с калием за счет электронов последнего образуется диборанат калия К2В2Не, в котором все связи двухэлектронные. [20]
Соединение с аналогичным дефицитом электронов приблизительного состава С8Вг образуется в результате реакции графита с элементарным бромом. По-видимому, составными элементами галогенных слоев являются здесь поли-бромидные цепи. Обусловленное структурой углеродного слоя расстояние между атомами брома 2 455 А соответствует кратчайшим расстояниям в решетке элементарного брома: г 2 27 и г. 2 3 31 А. Такая неустойчивость, возможно, связана с более ярко выраженной склонностью атомов хлора к образованию лишь двухцентро - ЕЫХ связей. [21]
Соединение с аналогичным дефицитом электронов приблизительного состава С8Вг образуется в результате реакции графита с элементарным бромом. По-видимому, составными элементами галогенных слоев являются здесь поли-бромидные цепи. Обусловленное структурой углеродного слоя расстояние между атомами брома 2 455 А соответствует кратчайшим расстояниям в решетке элементарного брома: г - 2 27 и г2 3 31 А. Такая неустойчивость, возможно, связана с более ярко выраженной склонностью атомов хлора к образованию лишь двухцентро-вых связей. [22]
В молекуле ВН3 дефицит электронов - атом бора имеет свободную орбиталь. В молекуле же H3N при атоме азота имеется неподеленная ( несвязывающая) электронная пара. Таким образом, молекула ВН3 может выступать как акцептор электронной пары, а молекула H3N, наоборот, - как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. [23]
В молекуле ВНа дефицит электронов - атом бора имеет свободную орбиталь. В молекуле же H8N при атоме азота имеется неподеленная или, как говорят, нежязывающая электронная пара. Таким образом, молекула ВН3 может выступать как акцептор электронной пары, а молекула HSN, наоборот, как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. [24]
В молекуле ВН3 дефицит электронов - атом бора имеет свободную орбиталь. В молекуле же HgN при атоме азота имеется неподеленная ( несвязывающая) электронная пара. Таким образом, молекула ВН3 может выступать как акцептор электронной пары, а молекула HgN, наоборот, - как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к обра-юванию четвертой ковалентной связи по донорно-акцепторному механизму. [25]
Несмотря на такой дефицит электронов, соединения этого типа иногда весьма устойчивы. Так, ферроцен перегоняется без разложения. [26]
VI, имеющим дефицит электронов, происходит легче, чем от неопентильной группы. Кроме того, в неопентильной системе с метальными углеродами связано шесть водородов и имеется лишь два протона метиленовой группы. Протон, отщепленный при образовании димера олефина, конечно, способен и дальше присоединяться к изоолефину с образованием третичного иона карбония, который может продолжать реакционную цепь. [27]
Эти заместители обусловливают дефицит электронов и могу г под действием реагента подвергаться анионоидному отрыву ( II) ( см. стр. [28]
Особым случаем молекул с дефицитом электронов являются гидриды бора. [29]
Страницы: 1 2 3 4 5
