Дефицит - электрон
Cтраница 4
Как видно, при таком рассмотрении никакого дефицита электронов не возникает. [46]
Кислоты Льюиса представляют собой соединения с дефицитом электронов в. [47]
 |
Температуры плавления и кипения боранов. [48] |
С водородом бор образует соединения с дефицитом электронов. [49]
Согласно Льюису, любое вещество с дефицитом электронов является кислотой, а обладающее неподеленными электронными парами, - основанием; наличие заряда при этом не обязательно. [50]
Уходящая группа стабилизирована благодаря тому, что дефицит электронов при ее атоме углерода компенсируется электронной парой кислорода. По отношению к уходящей группе реакция представляет собой элиминирование с образованием связи С О. [51]
Если же реагент имеет сильный и четко локализованный дефицит электронов, ему почти не требуется подача электронов со стороны арена: успешная атака возможна и без этого. Необходимую энергию приносит с собой сам реагент. [52]
Но, конечно, из соединений с дефицитом электронов лучше всего известны и наиболее изучены гидриды бора. Установлено, что структура самого простого гидрида - диборана В2Нв - содержит водородные мостики ( угол В - Н - В 82 5) с приблизительно тетраэдрическим расположением атомов водорода вокруг каждого атома бора ( ср. [53]
Избирательное поглощение органическими молекулами тоже связано с дефицитом электронов в молекуле. Полностью насыщенные соединения не проявляют избирательного поглощения ни в видимой, ни в доступной части УФ-области. Сопряженные двойные связи вызывают поглощение при больших длинах волн. [54]
Было подчеркнуто, что образование центра с дефицитом электронов при отрыве электрона от неподеленной пары или я-электрона не следует рассматривать как предварительное условие скелетной перегруппировки. Скорее это фактор, облегчающий отщепление двуокиси углерода. [55]
Карбены относятся к электрофиль-ным активным частицам: вследствие дефицита электронов они способны атаковать я-связь алкенов. И синглетный, и триплетный метилены реагируют с алкенами, образуя производные циклопропана. [56]
Эта неустойчивость, зависящая в свою очередь от дефицита электронов, обусловливает активность соответствующих соединений и может, между прочим, служить причиной спонтанных перегруппировок, особенно если карбокатионы, например II, обладают заметной несимметричностью. [57]
Но, подобно BF3, молекула С2 обладает дефицитом электронов: вокруг каждого атома углерода имеется всего только шесть валентных электронов. Но С2 имеет также неподеленные пары электронов и поэтому может выступать еще и в роли донора электронов. Экспериментально молекула С2 обнаруживается только при высоких температурах. При низких температурах каждый из двух атомов молекулы С2 акцептирует электроны от атома С другой молекулы С2 и одновременно отдает электроны, как донор, еще одному такому же атому. В результате возникает трехмерная структура, в которой каждый атом С связан ковалентными связями с тремя ( структура графита) или с четырьмя ( структура алмаза) другими атомами углерода. [58]
Карбены в синглетном состоянии представляют собой частицы с дефицитом электронов, что роднит их с ионами карбония, хотя подобно карбанионам они обладают свободной парой электронов. [59]
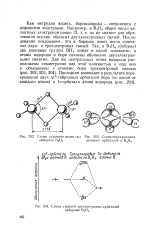 |
Схема строения молекулы [ IMAGE ] Схема перекрывания диборана В2Н0 атомных орбиталей в В2Н6.| Схема уровней трехцентровых орбиталей диборана В2НВ. [60] |
Страницы: 1 2 3 4 5