Диэтилперекись
Cтраница 3
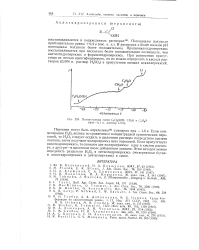
Так, гомогенное разложение ряда перекисей, например диэтилперекиси, дибензоилперекиси и ди-трет-бутилперекиси, гидроперекиси кумола и пероксосульфата, протекающее с гемолитическим разрывом связи О-О в газовой или жидкой фазе, обладает энергиями активации около 30 - 40 ккал / моль. Энергии активации при реакциях с другими веществами лежат ниже этого интервала и составляют всего лишь 10 ккал / моль. Как показывают приведенные на рисунке данные, для этой частной реакции между предэкспоненциальным множителем и энергией активации имеется прямая пропорциональность. При заданной температуре это соотношение показывает, что все приведенные на рисунке заместители в перекиси водорода снижают скорость реакции. В данном случае положение как раз обратно наблюдаемому при некаталитическом гомогенном разложении органических перекисей, где другие перекиси разлагаются быстрее, чем перекись водорода. Орр и Вильяме [ 14] интерпретируют результаты реакции с ионом закисного железа ( рис. 57) таким образом, что отталкивание избыточного электрона в связь О-О снижает энергию активации за счет увеличения числа электронов, способных к координации с закисным железом в активированном комплексе. [31]
В конце 30 - х годов имелись наблюдения, не совпадающие со взглядами М. Б. Неймана и по вопросу о механизме образования холодного пламени. Из них прежде всего следует указать на неудавшуюся попытку Гарриса и Эгертона [43] возбудить холодное пламя пропана добавкой диэтилперекиси в концентрации, являющейся при исследованной температуре критической для ее взрывного распада. [32]
Изменив состав применяемого для определения перекисей реактива путем добавления к нему в качестве катализатора ионов закисного железа, Виланд и Франке [1] получили количественные результаты для диэтилперекиси. [33]
Сам Нейман в 1949 г. столкнулся с этим явлением, правда, при исследовании реакции крекинга, а не окисления. Им было изучено влияние добавок диэтилперекиси в количестве до 3 % на крекинг бутана [61], проводившийся в статических ( Т 350, 403 и 462 С; Р 100 - 200 мм рт. ст.) и в струевых ( Т 500 - 529 С, Р 1 атм) условиях. Было показано, что скорость реакции практически не меняется от добавок диэтилперекиси. Рассмотрение этого вопроса В. В. Воеводским показало, что в данном случае как раз и имеет место преобладающая реакция рекомбинации радикалов, получающихся при распаде перекиси, над их взаимодействием с углеводородом. [34]
Предполагают, что она образуется под действием света и кирлорода на эфир и является причиной взрывчатости старого эфира. Однако, предположение это мало обосновано. Скорее всего это свойство эфира вызвано образованием веществ, взрьшающкх сильнее, чем Диэтилперекись. [35]
 |
Полярограмма смеси С2Н6ООН, СН2О и С3Н6О ( фон-0 1 н. раствор LiCl. [36] |
Если концентрация Н2О2 велика по сравнению с концентрацией органических перекисей, то Н2О2 следует осадить в щелочном растворе посредством ацетата лантана; затем получают полярограмму всех перекисей. Если присутствует ацилгидроперекись, то снимают две полярограммы: одну в кислом растворе, а другую-в щелочном после добавления лантана. Этим методом можно определить раздельно Н2О2 и метилгидроперекись ( четвертичные бутил-и ацилгидроперекиси и диэтилперекись) в смеси. [37]
Наличие ненасыщенной свдаи при подобном строении позволяло объяснить как образование перекиси из мол екуляр него кислорода и атомарного водорода, так и восста новитедьнуго способность. К тому же выводу пришли Штрекер i Шпиталер as7 в результате исследования молекулярной рефракции и рассеяния диэтилперекиси, с одной стороны, и диэтилэфира, с другой. Они считали, что как диэтшшерекись, так и перекись водорода имеют тройную связь между атомами кислорода. [38]
Диалкилперекиси являются более устойчивыми, чем перекиси других типов. В отсутствие катализаторов они не окисляют иоди-стоводородную кислоту в сколько-нибудь значительной степени ( см. гл. При титровании реактивом Фишера ни диэтил-перекись, ни ди-грег-бутилперекись - не мешают. При прямом титровании реактивом Фишера образца в 2 мл диэтилперекиси С2НБООС2Н5, разбавленного 25 мл сухого метанола, было найдено 1 34 0 00 % воды. [39]
Страницы: 1 2 3