Длина - водородная связь
Cтраница 1
Длина водородной связи пропорциональна ее энергии. [1]
Длина водородной связи пропорциональна ее энергии. Как видно из табл. 3.7, самые малые длины и самые высокие энергии найдены в водородных связях с участием атома кислорода, в частности между фенольными группами ( Туг-Туг) и в воде. Несколько большие расстояния и меньшие энергии у водородных связей между атомами азота и кислорода, и значительно меньшие энергии имеют водородные связи между двумя атомами азота, а также между атомами азота и серы. Для грубой оценки энергии водородных связей проще всего воспользоваться теплотой сублимации льда, которая составляет 13 ккал / моль. [2]
Длины водородных связей строго фиксированы и, как показывают многочисленные эксперименты, составляют несколько меньше ЗА. Энергия связи может быть измерена по спектрограмме. Действительно, при разрыве связи излучается волна длины К. Между энергией связи W0 и А, имеется однозначная связь: WQK / гс, где h - постоянная Планка, ас - скорость света. Спектрограммы содержат одну четкую линию без какого-либо размытия, что означает одинаковость длин волн, а, следовательно, энергия связей весьма строго фиксирована и потенциал связи Ф имеет форму узкой щели. [3]
Длины водородных связей в кислородных кислотах также находятся в монотонной зависимости от электро-отрицательностей центральных атомов соответствующих анионов. Уменьшение электроотрицатель-ностей этих элементов соответствует увеличению ионности связи Э - О и, следовательно, эффективного отрицательного заряда на атоме кислорода. [4]
 |
Строение отдельного комплекса в структуре пентагпдрата цинковой соли DL-гистидина, Вид вдоль двойной осп. [5] |
Длины водородных связей приведены ниже. [6]
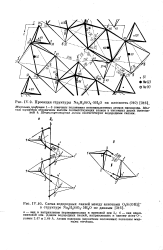 |
Проекция структуры Na2H2Si04 - 5H20 на плоскость ( 010.| Схема водородных связей между анионами 02Si ( OHi - в структуре Na2H2SiO4 - 5H20 по данным. [7] |
Длины водородных связей, направленных к одному иону О -, равны 2.67 и 2.89 А. Атомы водорода ( вероятные положения) показаны жирными точками. [8]
Длина водородной связи пропорциональна ее энергии. Как видно из табл. 3.7, самые малые длины и самые высокие энергии найдены в водородных связях с участием атома кислорода, в частности между фенольными группами ( Туг-Туг) и в воде. Несколько большие расстояния и меньшие энергии у водородных связей между атомами азота и кислорода, и значительно меньшие энергии имеют водородные связи между двумя атомами азота, а также между атомами азота и серы. Для грубой оценки энергии водородных связей проще всего воспользоваться теплотой сублимации льда, которая составляет 13 ккал / моль. [9]
Энергия и длина водородной связи в значительной мере определяются электрическим моментом диполя связи и размерами атома. Длина связи уменьшается, а энергия водородной связи возрастает с увеличением разности ЭО у атомов X и Y и соответственно электрического момента диполя связи X - Н и с уменьшением размера атома Y. Например, у молекул воды, у которых разница ЭО кислорода и водорода равна 0 5, длины связи в триаде О - Н - - - О равны 0 096 нм для О - Н и 0 204 нм для Н - - - О, энергия водородной связи Н - - - О составляет 21 51 кДж / моль. [10]
Почему при указании длины водородной связи обходят вопрос о положении водородного атома. [11]
ОСЮГ оказываются не меньшими, чем длины водородных связей, имеющие место в растворах. [12]
У веществ, приведенных в табл. 78, длина водородной связи составляет около 2 5 А. [13]
Расстояние Av между двумя полосами увеличивается с уменьшением длины водородной связи, и, следовательно, наблюдаемые значения Av для родственных диолов являются мерой относительной близости гидроксильных групп. В циклогексане все соседние пары водоро-дов находятся на равном расстоянии. В случае 1 2-диолов величины Av для цис - и транс-изомера соответственно равны 38 и 33 еж-1, что указывает на то, что в г ыс-диоле гидроксилы расположены ближе друг к другу, чем в транс-изомере. [14]
И электростатическое взаимодействие, и делокализация зарядов уменьшают длину водородной связи. Этому уменьшению препятствует отталкивание, энергия которого, оцененная полуэмпирически, составляет примерно 8 4 ккал / моль. [15]
Страницы: 1 2 3 4