Длина - ковалентная связь
Cтраница 2
В то же время это расстояние существенно превышает длины ковалентной связи Si-О 1 61 - 1 81 А во всех исследованных к настоящему времени соединениях кремния. Углы 0 ( 1) - Si ( 2) - N ( 2), O ( D-Si ( 2) - С ( 5 и O ( i) - Si ( 2) - C ( 6) ( ср. [16]
II показано, чти это рассшиние не следует рассматривать как длину чистой двойной ковалентной связи между атомами С и О, так как, кроме связей между атомами одного и того же элемента, все другие связи будут иметь частично ионный характер. [17]
Если при этом расстояния, отвечающие дополнительному координационному взаимодействию, сопоставимы с длинами ковалентных связей и координационное окружение атома олова близко к тригональ-ной бипирамиде или октаэдру для координационных чисел 5 и 6 соответственно, то само наличие такого взаимодействия сомнений кс вызывает. Однако, как будет показано ниже, в ряде случаев координационные взаимодействия оказываются довольно слабыми, и наиболее естественным геометрическим критерием наличия или отсутствия координации между двумя атомами в подобных структурах в принципе должно служить сокращение соответствующего расстояния по сравнению с суммой ван-дер-ваальсовых радиусов. [18]
Молекула ( Ве2О), по-видимому, линейная по своей форме и имеет длины ковалентных связей, равные 1 5 А. [19]
 |
Молекула F2 с ковалснтной связью F-F ( а и гипотетическая ионная молекула F F - ( б.| Расчетные и экспериментальные значения длины / АВ связей в некоторых молекулах. [20] |
Значения ковалентных радиусов, приведенные в табл. 7.1, удовлетворительно аддитивны, и длина ковалентной связи А-В в молекуле АВ может быть с достаточной точностью рассчитана как / АВ ГА гв. Некоторые расчетные значения / АВ приведены в табл. 7.2. Они хорошо согласуются с экспериментальными данными. [21]
 |
Средние энергии разрыва связей, кДж / моль. [22] |
Для предсказания геометрии молекулы надо знать тип гибридизации каждого из атомов молекулы, длины образуемых ковалентных связей и ван-дер-ваальсовы радиусы образующих молекулу атомов. [23]
В комплексных ионах независимо от того, являются ли они мономерными или полимерными, длины ковалентных связей между атомами, составляющими эти ионы, примерно равны характерным для данных атомов и данных связей. Это значит, что как составляющие кристаллической структуры ионы, подобно молекулам, имеют формы, к которым должны приспосабливаться другие составляющие. Сами по себе формы ионов могут изменяться, если отдельные группы принимают различные положения в результате вращения вокруг связей. Однако эти вращения ограничены, иногда так же строго, как в случае двойных связей. При наличии тройных связей, например - СС - или - CN, вся система линейна или приблизительно линейна, и вращение двух атомов, непосредственно прикрепленных простыми связями рядом с тройной связью, не влияет на их положение. Негибкость структур со связями этого типа может благоприятствовать образованию клеточных структур ( хотя и не обязательно к этому приводить), что и наблюдалось в некоторых случаях, о которых шла речь выше. [24]
Отсюда длина связи на 0 087 А, или на 5 %, меньше длины ковалентной связи, что указывает на ионный характер связи. Допустимо, что атом фтора в молекуле GIF является более отрицательным, учитывая его высокую электроотрицательность. [25]
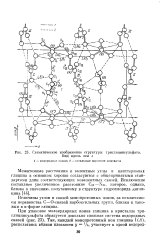 |
Схематическое изображение структуры триглицинсульфата. [26] |
Межатомные расстояния и валентные углы в цвиттерионах глицина в основном хорошо согласуются с общепринятыми стандартами длин соответствующих ковалентных связей. [27]
Неясным остается вопрос о возможности использования представлений об аддитивности ковалентных радиусов таких атомов, как сера и фосфор, для вычисления длины ковалентных связей. В книге Полинга не приведено ни одного примера приложения подобных представлений для вычисления длины ординарной связи S-О. Однако не следует забывать, что в этом соединении сера шестивалентная, и поэтому его следует с большой осторожностью использовать в качестве примера соединения с ординарной связью S-О. [28]
Считается, что каждому атому, участвующему в ковалентной связи, можно приписать кажущийся эффективный радиус, который является долей, вносимой им в длину ковалентной связи между ним и другим атомом, независимо от природы последнего. Если атом участвует в двойной или тройной связи, то его эффективный радиус уменьшается. [29]
 |
Сольватация растворителем, состоящим из небольших ( а и больших ( б молекул. [30] |
Страницы: 1 2 3 4