Длина - ковалентная связь
Cтраница 3
Следовательно, атомы второго слоя отстоят от молекулы растворенного вещества уже не на ван-дер-ваальсово расстояние, как было в случае сольватации водой, а лишь на длину ковалентной связи, которая значительно меньше суммы ван-дер-ваальсовых радиусов ( см. табл. 2.2, гл. Это значит, что второй слой атомов будет активнее участвовать в дисперсионных взаимодействиях с растворенным веществом. [31]
Значение В70 указывает на прочные связи в этих цепях и кольцах ( разрывается незначительное число этих связей), поэтому единственное вероятное расстояние до ближайшего соседнего атома равно длине ковалентной связи. [32]
Установление ковалентных радиусов атома возможно благодаря тому, что 1) длина простой ковалентной связи между данными двумя атомами постоянна в ряде молекул или ковалентных кристаллов и 2) длина ковалентной связи А - В есть средняя арифметическая длины связей А - А и В - В. Например, найдено, что и в алмазе, и в нормальных и в циклических парафинах, содержащих ряд взаимно-связанных групп СН2, расстояние С - С равно 1 544 0 02 А. Это постоянство длины связи позволяет считать, что связь С - С, длина которой заметно отличается от 1 54 А, не является простой связью с электронной парой. Например, в Н3С - С С - СН3 длина связи С - СН8 равна 1 46 А. Расстояние Si - Si в элементарном кремнии равно 2 34 А. Средняя арифметическая от 1 54 и 2 34 А равна 1 94 А, а расстояние С - Si в карборунде равно 1 93 А. Поэтому можно определить ковалентные радиусы элементов, сумма которых дает длину ковалентной связи между двумя атомами. [33]
Комплексы алкенов с солями металлов, например с нитратом серебра [ формула ( 31) ], построены так, что ион металла находится на одинаковом и несколько увеличенном по сравнению с длиной ковалентной связи расстоянии от обоих связанных двойной связью атомов углерода млкена. [34]
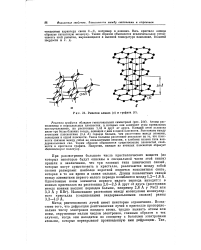 |
Решетки алмаза ( о и графита ( б. [35] |
При рассмотрении большого числа кристаллических веществ ( из которых некоторые будут описаны в специальной части этой книги) пришли к заключению, что три главных типа химических связей, которые могут существовать в кристалле, различаются между собой своими размерами: наиболее короткой является ковалентная связь, которая в то же время и самая сильная. Длины ковалентных связей между элементами первого малого периода колеблются между 1 2 - 1 8 А. Наименьшие расстояния между молекулами молекулярного кристалла ( соединенными вандерваальсовыми силами) равны 3 3 - 4 0 А. [36]
Полинг показал, что каждый ковалентно связанный атом занимает определенный объем, в первом приближении не зависящий от природы второго партнера. Поэтому длины ковалентных связей могут быть представлены как суммы ковалентных радиусов связанных атомов. [37]
 |
Схема водородных связей молекул воды в кристаллической решетке льда. / - водород. 2-кислород. [38] |
Из схемы следует, что все углы между направлениями связей в кристалле льда тетраэдрические, длина связей и их прочности - разные. Так, длина основной ковалентной связи О - Н равна 0 100 нм, а дополнительной ( межмолекулярной, водородной) почти в два раза больше - 0 176 нм. Таким образом, расстояние между атомами кислорода в кристаллах льда равно 0 276 нм. При плавлении это расстояние увеличивается до 0 290 нм. [39]
Ван-дер-ваальсов радиус характеризует размер данного атома по отношению к другим атомам, с которыми он не связан химическими связями. Кова-лентный радиус соответствует половине длины ковалентной связи между двумя одинаковыми атомами. [40]
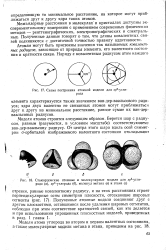 |
Схема построения атомной модели для / - углерода.| Стьюардовские атомные и молекулярные модели для р2 - угле-рода ( а, р3 - углерода ( б, молекул метана ( в и этана ( г. [41] |
Межъядерные расстояния в молекулах и кристаллах доступны экспериментальному измерению с применением современных физических методов - рентгенографических, электронографических и спектралъ-ных. Полученные данные говорят о том, что длины ковалентных связей подчиняются с достаточной точностью правилу аддитивности. [42]
Гибкость, или податливость, формы фермента обусловлена сравнительно малым энергетическим барьером для скручивания белкового каркаса вокруг ординарных связей. Согласно расчетам Рама-чандры и Сасихеран, изменение длины ковалентной связи в белковой молекуле на 0 1 А требует 0 22 эВ энергии, а изменение угла между связями на 5е требует около 0 01 В энергии. [43]
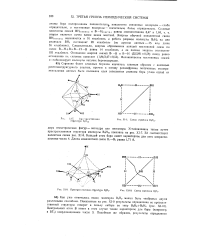 |
S. Схема строения В4Н1 (.. [44] |
Установленная таким путем пространственная структура молекулы В4Ню показана на рис. XI-7. Ей соответствует валентная схема рис. XI-8. Длина ковалентной связи BI-BI равна 1 71 А. [45]
Страницы: 1 2 3 4