А-цепь
Cтраница 4
Генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина приводит к талассемии. Если угнетается синтез р-цепей, развивается р-талассемия, а-цепей - а-талассе-мия. При р-талассемии наряду с НЬА в крови появляется до 15 % НЬА2 и резко повышается содержание HbF. Болезнь характеризуется поражением печени, селезенки, разрушением костного мозга, деформацией черепа, тяжелой гемолитической анемией. Талассемия несовместима с жизнью, так как а-цепи входят в состав всех гемо-глобинов. [46]
Поскольку обработка при таком ( восстановлении ведется в мягких условиях и приводит к хорошим выходам, этот метод представляет интерес для химика, занимающегося белками. Однако этим методом е удается открыть С-концевой аспараган в А-цепях; более того, при помощи его в молекуле инсулина обнаруживается присутствие одного [ 23а ] или двух [ 131 а ] С-концевых глициновых остатков. Если метод Зангера действительно является полным и точным, то приходится считать, что процесс восстановления вызывает разрыв некоторых особенно лабильных глициновых связей. [47]
Молекула включает 81 - 86 аминокислотных остатков ( в зависимости от вида животного); мол. На N-конце молекулы располагается В-цепь инсулина, на С-конце - А-цепь. [48]
Простая цепь в графе G называется А-цепью, если ее концевые вершины принадлежат множеству Л, но ни одна из ее внутренних вершин в А не содержится. Галлаи ( 1961) решил задачу отыскания максимального числа вершинно непересекающихся А-цепей сведением ее к задаче о паросочетании. [49]
Молекула включает 81 - 86 аминокислотных остатков ( в зависимости от вида животного); мол. На N-конце молекулы располагается В цепь инсулина, на С-конце - А-цепь. Цени инсулина соединены т.н. С-пептидом, построенным из 27 - 33 аминокислотных остатков. [50]
Различие этих форм невелико: две а-цепи молекулы гемоглобина S идентичны а-цепям молекулы гемоглобина А, а р-цепи различаются одним аминокислотным остатком. Цепь гемоглобина А имеет в шестом положении, считая от МН2 - конца полипептидной цепи, остаток глутаминовой кислоты, в то время как р-цепь гемоглобина S имеет в этом положении остаток ва-лина; все другие остатки аминокислот те же, что и в гемоглобине А. [51]
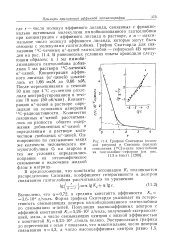 |
Графики Скатчарда ( основной рисунок и Сипсиана ( врезка связывания [ 14С1а - цепн гемоглобина на гаптоглобин-сефарозе ( и текст. [52] |
Вычислено, что а 0 72, а средняя константа аффинности Ка 3 6 - 104 л / моль. Форма графика Скатчарда указывает на гетерогенность связывающих центров иммобилизованного гаптоглобина по связыванию а-цепей. Популяция высокоаффинных центров с аффинной константой / d 5 26 - 105 л / моль, полученной экстраполяцией, мала, а число связывающих центров с низкой аффинностью с константой / ( 2 6 23 - 1 04 л / моль велико. [53]
Страницы: 1 2 3 4