А-эффект
Cтраница 3
Эффект, очевидно, будет проявляться в наименьшей степени, когда угол между заполненными орбиталями фтора и отриц тель-но заряженного углерода будет равным 90, и в наибольшей степени, если карбанион плоский. Таким образом, а-эффект должен препятствовать образованию плоской конфигурации, и его в первую очередь следует искать в случае карбанионов, в которых имеется сопряжение с ( - Ж) - заместителями. [31]
Если бы расположение С - Н - связей при р-углеродном атоме за счет частичного отщепления фенильной группы также все больше приближалось бы к плоскому, то можно было бы ожидать появления эффекта первого рода в направлении & H / & D 1 Отсутствие подобного эффекта на основании правила 2 должно указывать на то, что в переходном состоянии не происходит заметной пространственной переориентации р-атомов водорода. Если учесть также нормальную величину а-эффекта, то необходимо будет заключить, что разрыв связи в переходном состоянии происходит в сравнительно небольшой степени. Фенильная группа при этом не становится намного менее прочно связанной с р-углеродным атомом и частично присоединенной к а-атому углерода. На первый взгляд из этого следует, что данная реакция относится к обычным процессам 5 1-сольволиза. Можно было бы, конечно, предположить, что атомы водорода, находящиеся в р-положении, за счет слабого участия в реакции фенильных групп или по причинам пространственного характера вынуждены располагаться ниже узловой плоскости, так же как и в аналогичной реакции, представленной на рис. 12, а. [32]
Побочный продукт, гидразид, отделяется при нии. Гидразин - хороший нуклеофил ( так называемый а-эффект), атакующий ан-гидридоподобную фталильную группировку в условиях, при которых не затрагиваются пептидные связи. Тем не менее при наличии эфирных связей существует опасность гидразинолиза. На другие защитные группы обработка гидразином не влияет. [33]
Ка, а не с повышенной нуклеофильностью, необходимы дальнейшие исследования. Дженкс и Герштейн [140] показали, что а-эффект, по крайней мере частично, определяется свойствами основного состояния. [34]
Этот результат полностью определяет тензор а. В частности, видно, что неоднородность совместно с анизотропией обеспечивает наличие а-эффекта. [35]
Этот способ различения основан на том факте, что в реакциях переноса протона а-эффект не проявляется. [36]
Эффект не имеет простой и единой природы. На нуклеофильную реакционную способность соединений влияют столько различных факторов, существенных для проявления а-эффекта, что иногда можно усомниться в полезности этого термина. [37]
Как уже отмечалось в разд. Несомненно, что первоначально алкилирование происходит по азоту и в случае незамещенного гидроксиламина не наблюдается значительного а-эффекта. Этот факт служит еще одним подтверждением того, что при любом объяснении а-эффекта необходимо учитывать взаимодействие с я-связью в субстрате. [38]
Характерной особенностью строения соединений, обладающих аномально высокой реакционной способностью в реакциях нуклеофильного замещения с такими субстратами, как эфиры карбоновых кислот, производные кислот четырехкоорднна-ционного атома фосфора и другие соединения [244], является то, что по соседству с атомом, участвующим в нуклеофильной атаке, находится другой электроотрицательный атом ( как правило, атом азота), имеющий подвижную неподеленную пару электронов. По предложению Эдвардса и Пирсона [244] подобное наличие неподеленной пары электронов на а-атоме было названо а-эффектом. По-видимому, именно это обстоятельство обеспечивает более высокую поляризуемость реагентов в переходном состоянии. Следует также отметить, что в некоторых соединениях, характеризующихся высокой реакционной способностью, этот эффект может быть усилен, если по соседству с а-атомом находится л-электронное облако краткой связи. [39]
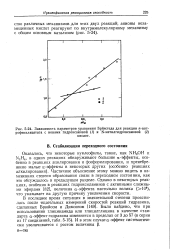 |
Зависимость параметров уравнения Бренстеда для реакции п-нит-рофенилацетата с ионами гидроксамовой ( / и N-метилгидроксамовой ( 2. [40] |
Однако в некоторых реакциях, особенно в реакциях гидроксиламинов с активными сложными эфирами [82], величина а-эффекта настолько велика ( 10в), что указывает на другую причину увеличения скорости. [41]
Остановимся на моделях, для которых магнитное поле генерируется а2 механизмом. Как показано выше, в этом случае генерация тороидального поля из полоидального и обратно - обусловлена а-эффектом. [42]
Влияние структуры СН-кислоты на рКа, а также разнообразные механизмы стабилизации карбанионов подробно рассматривались Крамом [ 11, поэтому мы остановимся лишь на основных структурных эффектах, имеющих достаточно общий характер. К таким эффектам относятся индуктивный, мезомерный ( включая эффект ароматизации, гиперконъюгации и гомосопряжения), а-эффект и d - орбиталъные эффекты, которые обусловливают так называемый гог-эффект. [43]
Вместе с тем вопрос о том, не присущи ли явления ВМК, как молекулярного свойства, элементоорганическим соединениям ( ЭОС), у которых в молекуле имеется донорный центр, отделенный от акцепторного несколькими метиленовыми группами, является весьма важным. Этот вопрос возник, в частности, в связи с тем, что в литературе широко обсуждался а-эффект в соединениях, имеющих группы М - СН2 - X, причем критика его бывала не всегда убедительной. [44]
Страницы: 1 2 3 4
