Аргиназа
Cтраница 3
Возможно, что второй этап тоже активируется гормоном щитовидной железы. Сравнимый процесс сборки несколько менее подробно описан для глутаматдегидрогеназы; может быть, от такого же процесса зависят различия в аргиназе у амфибий до и после метаморфоза. Весьма возможно даже, что под каким-то эпигенетическим контролем находится и сборка всех других олигомер-ных ферментов цикла мочевины. Поскольку для разных ферментов цикла этот контроль может быть различным, нам не покажутся неожиданными обнаруженные различия в процентном повышении активности отдельных ферментов цикла мочевины во время уреотелической адаптации. [31]
С помощью выбранного соответствующим образом фермента можно также селективно разрушить один из изомеров. Например для получения / - метионина [299] и / - аланииа [300] применяется - амшооксидаэа, для получения - аргинина [301] - аргиназа и для Получения d - цистина [302] - десульфгидраза циетеша. Однако этот метод менее эффективен, чем о-ба предыдущих, так как при применении его теряется один из изомеров; кроме того, он является менее общим. [32]
Названия многих ферментов образуются путем прибавления суффикса-аза к названию их субстрата. Так, ф ермент, катализирующий гидролиз мочевины, называется уреазой ( от англ: urea), - a фермент, гидролизующий аргинин - аргиназой. Однако многие ферменты имеют названия, не связанные с названиями их субстратов, например пепсин и трипсин. Случается также, что один и тот же фермент имеет по меньшей мере два названия или же два разных фермента носят одно и то же название. Из-за этих и других затруднений терминологического характера, а также вследствие все возрастающего числа вновь открываемых ферментов было принято международное соглашение о создании систематической номенклатуры и классификации ферментов. Каждый фермент имеет четырехзначный кодовый номер ( шифр) и систематическое название, которое позволяет идентифицировать катализируемую этим ферментом реакцию. [34]
К начальному участку кинетической кривой проводят касательную - и определяют ее наклон; калибровочная кривая представляет собой зависимость наклона AE / At от концентрации фермента ( линейная область для двух электродов, содержащих 410 мг уреазы / мл полимерного геля, наблюдается при концентрации аргиназы от 1 58 до 39 38 ед. [35]
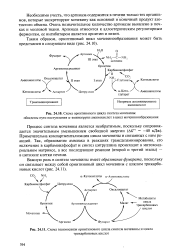 |
Схема орнитинового цикла синтеза мочевины. обведены пути поступления а-аминогрупп аминокислот в цикл мочевинообразования.| Схема взаимосвязи орнитинового цикла синтеза мочевины и цикла. [36] |
Необходимо учесть, что аргиназа содержится в печени только тех организмов, которые экскретируют мочевину как основной и конечный продукт азотистого обмена. Очень незначительное количество аргиназы выявлено в почках и мозговой ткани. Аргиназа относится к аллостерическим регуляторным ферментам, ее ингибитором является орнитин и лизин. [37]
У человека, потребляющего ежедневно 100 г белка, образуется в О. У тех животных, у к-рых отсутствует аргиназа, О. [38]
Обычно орнитин не входит в состав белков. Было сделано предположение, что для образования этих остатков используется специальная аргиназа, которая, вероятно, отсутствует в некоторых случаях подагры, когда сильно снижена способность крови ft связыванию уратов. [39]
Эта аминокислота отличается от аргинина лишь тем, что вместо гуанидиновой группы в ней содержится остаток мочевины. Карбонильная группа цитруллина в результате реакции переаминирования, протекающей с участием а-амино-группы аспарагиновой кислоты, превращается в иминогруппу. При этом образуются фумаровая кислота и аргинин, который гидролитически расщепляется ферментом аргиназой на мочевину и орнитин, после чего весь цикл превращений аминокислот начинается сначала. [40]
Эта аминокислота отличается от аргинина лишь тем, что вместо гуанндиновои группы в пей содержится остаток мочевины. Карбонильная группа цитруллина в результате реакции переамппированпя, протекающей с участием а-амино-группы аспарагиповой кислоты, превращается в имипогруппу. При этом образуются фумаровая кислота и аргинин, который гидролитически расщепляется ферментом аргиназой на мочевину и орнитин, после чего весь цикл превращений аминокислот начинается сначала. [41]
 |
Зависимость скорости катализируемой ферментом реакции от рН ( стрелка указывает оптимум рН.| Оптимальные значения рН для некоторых ферментов. [42] |
Из данных табл. 4.3 видно, что рН - оптимум действия ферментов лежит в пределах физиологических значений. Объясняется это, во-первых, структурной организацией молекулы фермента и, во-вторых, тем, что пепсин является компонентом желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН - оптимум аргиназы лежит в сильнощелочной зоне ( около 10 0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды. [43]
Соединения с Apr, Гис и Три до сих пор исследованы очень мало. Сложные дипептиды, содержащие эти аминокислоты, вряд ли можно детектировать. Это может оказаться полезным, так как после триптического гидролиза больших пептидов благодаря его специфичности часть остатков Apr будет находиться в С-концевом положении фрагментов. При обработке этих пептидов аргиназой соответствующие С-концевые аминокислотные остатки превращаются в Орн, что делает пептиды доступными для ГХ. После частичного кислотного гидролиза пептиды, содержащие Три, практически не образуются, поскольку во время этой процедуры происходит раз-руо. [44]
Благодаря стараниям Рождерса больным девочкам был привит вирус Шоупа, и у них постоянно брали кровь на анализ, чтобы отыскать следы аргиназы. Но вот после месяцев ожидания у обеих девочек стала вырабатываться аргиназа. [45]
Страницы: 1 2 3 4
