Добавление - электрон
Cтраница 1
Добавление электрона к некоторым органическим молекулам вызывает их немедленную диссоциацию. Примером могут служить органические галогениды ( гл. [1]
Добавление двенадцатого электрона соответствует образованию атома магния, где над остовом неона рас полагаются уже два электрона ( Is22s22p22p 2p 3s2) подобно тому как в атоме бериллия два электрона рас положены над остовом гелия. Отсюда следует химиче ское подобие магния и бериллия. [2]
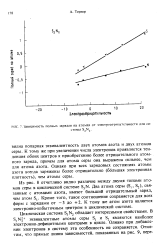 |
Зависимость полных зарядов на атомах от электроотршщтельности для системы S Nj. [3] |
Однако при добавлении электронов в систему эта особенность не сохраняется. [4]
К сожалению, добавление электрона вызывает очень сильные изменения в электронной структуре системы: оболочки могут стать открытыми, меняется мультиплет-ность. Волновая же функция г з ( k) может никак этого не учитывать. Поэтому более низкое значение для E ( N) может порождаться просто нарушением симметрии. [5]
С химической точки зрения добавление электронов к плоскому ароматическому кольцу должно обычно выводить некоторые атомы из плоскости. Существенно то, что цикл сводится к такой конфигурации, например, когда бензол становится дианионом цикло-гексадиена. [6]
Прежде чем рассматривать влияние добавления электрона к молекуле, удалим один электрон с образованием однозарядного положительного иона. Рассмотрим ион только в основном состоянии, как правило, соответствующем удалению одного электрона с ВЗМО молекулы. Этот процесс можно тщательно исследовать с помощью фотоэлектронной спектроскопии. Причина этого показана на рис. 12, изображающем поверхность потенциальной энергии для молекулы и иона в их основных состояниях. Ординатой является одна из нормальных координат молекулы, которая может иметь весьма отличающееся равновесное значение в ионе. [7]
Маделунга определяют, является ли энергетически выгодным добавление электрона к атому примеси. [8]
Для облегчения изучения электронной структуры молекулы при добавлении электронов один за другим к ядру атома целесообразно построить систему квантовых чисел, относящихся к молекуле. Вследствие присутствия второго ядра и принадлежащих ему электронов силовое поле в молекуле уже не является центрально-симметричным, и при этих обстоятельствах квантовые числа п и I теряют свое простое физическое значение. [9]
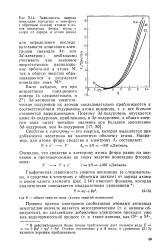 |
Зависимость энергии ионизации ( сродства к электрону с обратным знаком атомов и ионов кислорода, фтора, неона и хлора от заряда q атома ( иона. [10] |
Сродство к электрону - это энергия, которая выделяется при добавлении электрона на валентную оболочку атома. Например, для атома фтора сродство к электрону Ае составляет: F е - - F Ае ДЯ - 337 кДж / моль. [11]
Наибольшими значениями Лх обладают атомы галогенов, что объясняется достройкой их электронной оболочки при добавлении электрона до оболочки соответствующего инертного газа. [12]
Рассмотрим теперь относительные полные силы различных супермульти-плетов в совокупности пареходов между двумя конфигурациями, образованными посредством добавления электрона к одной и той же исходной конфигурации. Полная сила супермультиплета получается из (9.10) при тех же заменах, которые производились в (9.9) для получения относительных сил мультиплетов. Это сразу показывает, что сила различных супермультиплетов совокупности переходов пропорциональна ( 2S - J - l) ( 2LI - f - 1), где /, есть значение /, в исходном ионе, а 5 - мультиплетность супермультиплета. [13]
В предыдущей главе мы видели на примере элементов третьего периода периодической таблицы, как изменяются свойства при добавлении электронов на внешнюю электронную оболочку атома. Мы установили, что существует определенная связь между увеличением числа электронов и переходом от металлических свойств элементов к неметаллическим, от основных свойств гидроокисей к кислотным, от простых ионных соединений к простым молекулярным соединениям. [14]
Мы видели, что даже при низких температурах золото в германии может иметь четыре состояния ионизации и что наблюдаются три значения энергии, соответствующие добавлению электронов к однократно положительному, нейтральному и однократно отрицательному атому золота. Кроме различных энергий ионизации, эти состояния характеризуются в высшей степени разными значениями сечений захвата для электронов и дырок, причем свободный донорный уровень является наиболее эффективным центром захвата для электронов, а занятые акцепторные уровни благодаря наличию кулоновских сил-центрами захвата дырок. [15]
Страницы: 1 2 3 4