Арре-ниус
Cтраница 1
Арре-ниуса - Оствальда [4] были вмонтированы в пробку. Для определения емкости сосуда применялся 0 02 молярный раствор химически чистого, перекристаллизованного, осажденного спиртом и прокаленного хлористого калия. [1]
Арре-ниуса) в уравнении для скорости реакции; Е - энергия активации реакции при заданной температуре Т; индексы 1 и 2 относятся к реакциям ( Т - la) и ( 1 - 16) соответственно. [2]
Арре-ниуса ( рис. 2), на основании - чего нами вычислены кажущиеся энергии активации отдельных реакций. [3]
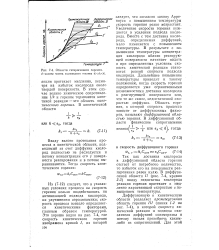 |
Области гетерогенного горения. d - размер частиц пылевидного топлива di 2 3. [4] |
Арре-ниуса с повышением температуры скорость горения резко возрастает. Увеличение скорости горения нуждается в усилении подвода кислорода. Вместе с тем доставка кислорода, определяемая диффузией, мало изменяется с повышением температуры. В результате с повышением температуры концентрация кислорода вблизи реагирующей поверхности начинает падать и при определенных условиях скорость химической реакции становится равной скорости подвода кислорода. Дальнейшее повышение температуры приводит к такому положению, когда скорость горения определяется уже ограниченными возможностями доставки кислорода к реагирующей поверхности или, что то же самое, недостаточной скоростью диффузии. Область горения, в которой скорость процесса зависит от диффузионных факторов, называют диффузионной областью горения. [5]
Арре-ниуса для скорости реакции, разд. Вследствие этого область вблизи контакта между кристаллами оказывается без носителей электричества и ток прекращается. [6]
Теория Арре-ниуса хорошо описывала многие свойства растворов электролитовг но совершенно не учитывала влияние растворителя-в этом заключалась ее слабая сторона. [7]
 |
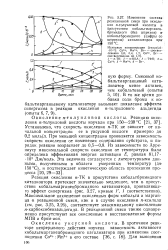
Графический способ нахождения коэффициентов в уравнении Аррениуса по опытным данным. [8] |
Постоянные в уравнении Арре-ниуса можно найти также, если определить две константы скорости при двух температурах. [9]
 |
Изменение состава реакционной смеси при окисле -. нии п-толуиловой кислоты в присутствии кобальтмарганец-бромидного ( без штрихов и кобальтбромидного ( цифры со штрихом катализаторов при 150 С. [10] |
Из зависимости по Арре-ниусу максимальной скорости окисления от температуры была определена эффективная энергия активации Е, равная 81 17 - 103 Дж / моль. [11]
Классическая теория электролитической диссоциации Арре-ниуса принимает скорость движения ионов постоянной, не зависящей от концентрации раствора. Поэтому эффект изменения эквивалентной электропроводности раствора с разбавлением его эта теория относит исключительно за счет повышения степени диссоциации электролита а ( см. стр. [12]
 |
Схема горения углеродной частицы. [13] |
В соответствии с законом Арре-ниуса определяющим параметром в скорости химической реакции является температура процесса. [14]
Вещество С называют промежуточным комплексом Арре-ниуса; его концентрация может быть значительной. [15]
Страницы: 1 2 3 4