Константа - скорость - распад
Cтраница 1
Константа скорости распада по первой кривой выражается уравнением реакции первого порядка [420] &, 109 6 - lQ - 28 / сек-1, где Q 2 3 RT ккал / моль. Процесс термического дегидрохлорирования ПВХ с энергией активации 28 ккал / моль может быть вызван нестабильными структурами: перекисными группами или фрагментами макромолекул, содержащими аллильный хлор у неконцевых двойных связей. [1]
Константа скорости распада ( бензол, 50 С) перекиси бензоила равна 0 048 - 10 с -, а mpem - бутилпероксидикарбо-ната - 8 85 tO - s и-3. Приняв эффект н-вность инициирования 0 6 л 0 8 и массу инициаторов соответа веняо 27 225 и 26 325 т, определите соотношение скоростей инициирования в начальный момент времени, через 20 мин и через 5 ч от начала реакции, если объемы реакционных смесей при температуре опыта одинаковы, а константы скорости и эффективность можно считать неизменлылги в ходе реаккмя. [2]
Константа скорости распада циклогексана при большой глубине реакции равна 6 - 1013е - 3186С / Г с -, что очень близко к константе скорости распада н-гексана. Для алкилзамещенных циклогекса-нов константа скорости выше, что связано с появлением третичной связи С - Н, существенно менее прочной, чем связь СВТор-Н в цик-логексановом кольце. Так, константа скорости распада для этил-циклогексана при 700 К примерно в 6 раз больше, чем для циклогексана. [3]
 |
Сопоставление вычисленных и измеренных концентраций перекисных радикалов. [4] |
Константа скорости распада АИБН практически не зависит от природы растворителя. Приведенная формула получена по экспериментальным значениям констант скорости распада АИБН в разных растворителях. Измеренные в работе [175] значения констант скорости распада АИБН в кумоле ( 4 7х ХЮ-4 1 / сек) и этилбензоле ( 4 4 - 10 - 4 1 / сев) при 90 С близки к величине 4 71 - 10 - 4 1 / сек, вычисляемой по этой формуле. [5]
Константа скорости распада возбужденной молекулы пропорциональна этому фактору вероятности и фактору пропорциональности v, связанному со скоростью переноса внутренней энергии. [6]
 |
Константы Михаэлиса для ферментивного гидролиза нехолиновых эфиров. [7] |
Однако константа скорости распада этого комплекса ( молекулярная активность), определяющая максимальную скорость реакции, в случае индофенилацетата, как видно из данных табл. 15, меньше, чем в случае ацетилхолина. [8]
Какова константа скорости распада изотопа, если 87 5 % его распадается в течение 4 лет. [9]
Какова константа скорости распада изотопа, если 87.5 % его распадается в течение 4 лет. [10]
 |
Скорость мономолекулярного распада перекиси водорода ( 1 и органических гидроперекисей ( 2 при температуре 115. [11] |
Сравнение констант скорости распада, вычисленных по данным рис. 3 и представленных в таблице, приводит к выводу, что гидрооксиперекись, образующаяся при окислении изопро-пилового спирта, распадается на молекулярные продукты почти в 1 5 раза быстрее, чем перекись водорода. Указанные термодинамические и кинетические данные практически проявляются в том факте, что при выделении перекиси водорода из реакционных смесей ректификацией органические перекисные соединения, образовавшиеся при окислении изопропилового спирта наряду с перекисью водорода, при нагревании разлагаются на ацетон и перекись водорода почти полностью в то время, как разложение перекиси водорода практически отсутствует. Дальнейший ход кинетических кривых накопления перекиси водорода и органических перекисных соединений ( рис. 1 и 5) характеризуется появлением максимумов, после которых начинается расходование перекисных соединений с падением их концентрации и теоретического выхода. При этом опять распад органических перекисей несколько опережает распад перекиси водорода, что согласуется с положениями, высказанными выше о меньшей устойчивости гидроперекиси. [12]
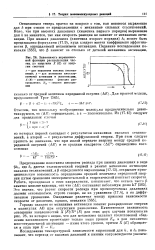 |
Зависимость неравновесной функции распределения частиц по энергиям X ( Е от энергии системы. [13] |
Представление константы скорости распада при низких давлениях в виде ( Усе, где ku дается статистической теорией в рамках механизма активации сильных столкновений, а 6 определяется выражением (17.15), открывает принципиальную возможность определения средней величины переданной энергии путем сравнения экспериментальной и теоретической констант скорости. Это значит, что расчет скорости распада при промежуточных давлениях должен основываться, строго говоря, не на уравнении (17.4), а на диффузионном уравнении. [14]
 |
Скорость мономолекулярного распада перекиси водорода ( 1 и органических гидроперекисей ( 2 при температуре 115. [15] |
Страницы: 1 2 3 4