Константа - скорость - распад
Cтраница 2
Сравнение констант скорости распада, вычисленных по данным рис. 3 и представленных в таблице, приводит к выводу, что гидрооксиперекись, образующаяся при окислении изопропилового спирта, распадается на молекулярные продукты почти в 1 5 раза быстрее, чем перекись водорода. Указанные термодинамические и кинетические данные практически проявляются в том факте, что при выделении перекиси водорода из реакционных смесей ректификацией органические перекисные соединения, образовавшиеся при окислении изопропилового спирта наряду с перекисью водорода, при нагревании разлагаются на ацетон и перекись водорода почти полностью в то время, как разложение перекиси водорода практически отсутствует. Дальнейший ход кинетических кривых накопления перекиси водорода и органических перекпсных соединений ( рис. 1 и 5) характеризуется появлением максимумов, после которых начинается расходование перекиспых соединений с падением их концентрации и теоретического выхода. При этом опять распад органических перекисей несколько опережает распад перекиси водорода, что согласуется с положениями, высказанными выше о меньшей устойчивости гидроперекиси. [16]
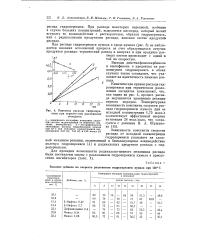 |
Кинетика расхода гидроперекиси при термическом разложении оксидатов. [17] |
Зависимость константы скорости распада от исходной концентрации гидроперекиси указывает на сложный механизм реакции, включающий и бимолекулярное взаимодействие молекул гидроперекиси [4] и радикальных продуктов распада с гидроперекисью. [18]
Определить константу скорости распада пероксида бензоила в диоксане при 80 С, если начальная концентрация его была 1 1 %, а через 10 мин иодометрически в системе было обнаружено 1 07 % пероксида бензоила. [19]
АО - константа скорости распада инициатора У; р - число радикалов, образующихся при распаде молекулы инициатора, характеризует не скорость окисления, а скорость инициирования. [20]
 |
Термический распад трипитротриазидобензола. [21] |
Сопоставление значений констант скорости распада при разных температурах ( 20 - 100 С) приводят к энергии активации распада твердого тринитротриазидобензола, равной 32 300 кал / моль. [22]
Рассчитаны значения констант скоростей распада НСООН и кажущаяся энергия активации. [23]
Выведите зависимость константы скорости распада инициатора от начальных концейтраций инициатора и ингибитора, эффективности инициирования и длительности индукционного периода, если инициатор распадается по схеме I - - 2R, а одна молекула ингибитора связывает один свободный радикал. [24]
Выведите зависимость константы скорости распада инициатора от начальных концентраций инициатора и ингибитора, эффективности инициирования и длительности индукционного периода, если инициатор распадается по схеме I - 2R, а одна молекула ингибитора связывает один свободный радикал. [25]
Различие между константой скорости распада озонида и константой скорости образования валериановой кислоты объясняется параллельной реакцией образования муравьиной кислоты и валерианового альдегида. [26]
В условиях опыта константа скорости распада инициатора мала, и за время опыта концентрация его практически не меняется, поэтому окисление идет с постоянной скоростью. [27]
Определение истинной величины константы скорости распада перок-сида осложняется протеканием индуцированного распада, обусловленного взаимодействием радикальных продуктов с молекулами исходного соединения. Поскольку эти реакции конкурируют с реакциями цепного разложения и имеют низкую энергию активации, вклад их уменьшается с ростом температуры по сравнению с простым гемолизом. Чтобы оценить вклад индуцированного распада, изучают, как влияет на реакцию снижение давления пероксида. Для подавления индуцированных реакций вводят также акцепторы свободных радикалов, в первую очередь NO и NO2, а также толуол. [28]
Величина, обратная константе скорости распада А, будет средним временем жизни А. Таким образом, период автокатализа по порядку величины близок к времени жизни разветвляющего продукта. [29]
 |
Кинетика распада радона-222. [30] |
Страницы: 1 2 3 4