Аспартат
Cтраница 2
Подобным образом окисление аспартата может приводить к образованию глутамата через оксалоацетат, цитрат, г мс-аконитат, изоцитрат и а-кетоглутарат. Кетоглутарат акцептирует аминогруппу от аспартата; в результате дезами-нирования аспартата образуется молекула оксалоацетата, которая окисляется до а-кето-глутарата. [16]
АСПАРТАТАМИНОТРАНСФЕРАЗА ( Ь - аспартат: 2-оксо-глутарат аминотрансфераза), фермент класса трансфераз, катализирующий при участии кофермента пиридоксаль-5 - фосфата обратимый перенос аминогруппы ( трансаминиро-вание) от Ь - аспарагиновой к-ты ( ф-ла I) на 2-оксоглутаро-вую ( II) с образованием щавелевоуксусной ( III) н Ь - глута-миновой ( IV) к-т. [17]
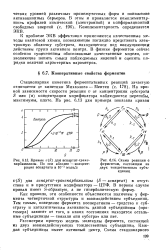 |
Кривые v ( S для аспартат-т-раис-карбамилазы. По оси абсцисс - концентрация аспартата в 10 - 3 моль / л.| Схема реакции с ферментом, состоящим из двух тождественных субъединиц. [18] |
Транскарбамилазы ( S - аспартат) в отсутствие и в присутствии модификатора - ЦТФ. В первом случае кривая имеет S-образную, а не гиперболическую форму. [19]
Прямое включение аммиака в аспартат обнаруживается главным образом у растений и микроорганизмов под влиянием аспартатаммиаклиазы. [20]
Каков будет процент превращения фумарата в аспартат в каждом варианте. Если же используется реакция получения фумарата из аспартата, то при какой исходной концентрации аспартата ( высокой или низкой) процент превращения реагента в продукт будет выше. [21]
Перенос карбамоильной группы с карбамоилфосфата на аспартат; ( рис. 14 - 29, стадия а) приводит к образованию продукта, способного к немедленной циклизации путем элиминирования воды; в результате образуется дигидрооротат. Карбамоилтрансфераза является в высокой степени регулируемым ферментом, и в настоящее время она служит объектом интенсивных исследований ( гл. Дигидрооротат окисляется особым флавопротеидом за счет NAD, являющегося внешним окислителем. [22]
Один из изоферментов, катализирующих превращение аспартата в аспар-тилфосфат, может аллостерически инги-бироваться двумя различными модуляторами-лизином и изолейцином, действие которых более чем аддитивно. Это еще один пример согласованного ингиби-рования ( разд. [24]
На II стадии карбамоилфосфат реагирует с аспартатом, в результате чего образуется N-карбамоиласпарагиновая кислота. Последняя подвергается циклизации ( под действием дигидрооротазы) с отщеплением молекулы воды, при этом образуется дигидрооротовая кислота, которая, подвергаясь дегидрированию, превращается в оротовую кислоту. В этой реакции участвует специфический НАД-содержащий фермент дигидро-оротатдегидрогеназа. [25]
Так аспарагиновая кислота ( ее соли - аспартаты) получается из щавелевоуксусной ( ее соли оксалоацетаты) и какой-либо аминокислоты. [26]
Заряд белков обусловлен в первую очередь остатками аспартата и глутамата, имеющими при нейтральном и щелочных значениях рН отрицательный заряд, и остатками лизина и аргинина, имеющими при слабоосновных и тем более при нейтральном и кислых рН положительный заряд. По мере повышения рН заряд белков проходит от положительных к отрицательным значениям и в изоэлектри-ческой точке ( см. § 3.1) оказывается равным нулю. Вблизи этой области белок оказывается лишенным ионной атмосферы и его молекулы могут беспрепятственно сближаться до радиуса действия ван-дер-ваальсова притяжения. В ряде случаев это приводит к выпадению белка в осадок. Такой способ выделения белков из раствора называют изоэлектрическим осаждением. [27]
Будут ли у вас обнаруживаться признаки недостаточности аспартата на рационе, который богат аланином, но беден аспартатом. [28]
Нам особенно интересно будет рассмотреть действие соли на аспартат - карбамоилтрансферазу галофильных бактерий. Если предположить, что она, подобно другим галофильным белкам, тоже отличается значительно большей кислотностью, то как это могло бы отразиться на ее структуре. Состоит ли этот фермент также из каталитических и регуляторных протомеров. Чувствителен ли он в той же мере к модуляции по типу обратной связи. Влияет ли соль на регуляторные и каталитические субъединицы одинаковым образом. [29]
Страницы: 1 2 3 4

