Аспартат
Cтраница 3
К числу таких веществ относятся глутамат; глу-тамин, аспартат, глицин и у-амтобути-рат. В качестве нейромедиаторов либо ингибиторов могут функционировать производные других аминокислот, а также некоторые пептиды и аиетшхолин. В ответ на потенциал действия, возникший на мембране аксона, содержимое отдельных пузырьков изливается в синаптическую щель и связывается со специфическими рецепторными участками в чувствительном окончании пост-синаптического нейрона, тем самым стимулируя его к дальнейшей передаче импульса. После стимуляции постсинап-тического нейрона высвобожденный в синаптическую щель нейромедиатор должен быть либо быстро разрушен ферментами, либо реабсорбирован в пре-синаптическое нервное окончание, иначе синапс не будет способен к проведению следующего импульса. Ферментативная инактивация нейромедиатора ацетилхо-лина осуществляется в синаптической щели с помощью ацетилхолинэстеразы, гидролизующей этот медиатор до ацетата и свободного холина ( разд. [31]
С фермента аспартат - карбамоилтрансфера-зы ( АКТазы, называемой также аспартат - транскарбамилазой) начинается путь биосинтеза пиримидинов и нуклеотидов ( фиг. Пока нуклеозидфосфаты расходуются на образование нуклеиновых кислот, АКТаза продолжает катализировать синтез первого продукта - карба-моиласпартата. Однако, если один из конечных продуктов, цитидинтрифосфат ( ЦТФ), начинает накапливаться, АКТаза ингибируется и синтез пиримидинов и нуклеотидов прекращается. [32]
Глутамат после дезаминирования может превратиться в цикле трикарбоновых кислот в аспартат через а-кетоглутарат, сукцинат, фумарат, малат и оксалоацетат. Оксалоацетат затем превращается в аспартат путем пере-аминирования с глутаматом, а образующаяся при этом молекула сс-кетоглутарата используется для окисления аспартата. [33]
Шидт и Бек-Беренс [248], используя 3 - С14 - аспартат, обнаружили значительное включение метки в положения 2 и 3 молекулы рицинина. [34]
Энзимологическая основа ингибирования активности фермента конечным продуктом лучше всего изучена для аспартат - карбамоил-трансферазы. [35]
Виртанен предположил, что при ассимиляции NH2OH должен скорее всего образоваться аспартат. [36]
Предполагают, что некоторыедекарбоксилазыживотныхтканей декарбоксилирующие, например, S-аденозилметионин, фосфатидилсерин и аспартат, также содержат пируват. [37]
Нет; азот аланина может посредством трансаминирования переноситься на окса-лоадетат с образованием аспартата. [38]
Эти два обобщения хорошо иллюстрируются данными о двух важных регуляторных ферментах - НАДФ-изоцитратдегидроге-назе и аспартат - карбамоилтрансферазе. [39]
Наиболее важные, узловые аминокислоты названы на схеме полностью ( глицин, глутамат, аспартат, треонин, метионин), остальные обозначены сокращенными названиями. Оба эти звена питают всю цепь синтеза аминокислот. Линии между I и V указывают пути синтеза нуклеиновых кислот. Эти кислоты получаются из пуринов и пиримидинов, в свою очередь связанных с аспартатом и глицином. Глицин и аминолевулиновая кислота - сырье для синтеза важнейшего компонента дыхательной цепи - тема, на основе которого получаются цитохомы и активные группы различных окислительно-восстановительных ферментов. [40]
В соответствии со сказанным при нейтральном рН носителями отрицательного заряда белковой молекулы являются карбоксильные группы аспартата и глутама-та, а также С-концевая карбоксильная группа, которая может принадлежать любой аминокислоте. Аналогично, носителями положительного заряда в нейтральной среде в первую очередь являются остатки лизина и аргинина, аминогруппа N-концевой аминокислоты и в некоторой степени остатки гистидииа. Белки, у которых число карбоксильных групп существенно превышает число остатков аргинина и лизина в нейтральной среде, имеют отрицательный заряд и относятся к числу кислых белков. [41]
Каталитический центр для всех трех ферментов представлен тремя главными аминокислотными остатками - серином, гистидином и аспартатом. [42]
Будут ли у вас обнаруживаться признаки недостаточности аспартата на рационе, который богат аланином, но беден аспартатом. [43]
В процессе кратковременного фотосинтеза С14 из углекислого газа включается в несколько аминокислот: глицин, серии, аланин и аспартат. При несколько более длительном фотосинтезе радиоактивный углерод обнаруживается еще в одной аминокислоте. Однако есть все основания считать, что эта аминокислота образуется вне хлоропластов в результате постфотосинтетических превращений углерода, связанных с функционированием цикла Кребса. Тем не менее, глутамату придается большое значение в реакциях фотосинтетического образования аминокислот. Дело в том, что глутамат может выступать в роли донора аминогрупп в реакциях переаминиро-вания, приводящих к образованию аспартата, серина, глицина и, быть может, аланина. Результаты этих опытов представлены на фиг. Оказалось, что N15 включается быстрее в состав глутамата, чем в аспартат и аланин, а С14 - наоборот - позже в глутамат. Характер изменения во времени содержания N15 в этих аминокислотах позволяет сделать вывод о том, что глутамат, образующийся-при прямом ами-нировании а-кетоглутарата, может использоваться в реакциях трансаминирования. [44]
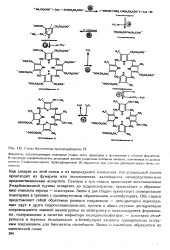 |
Схема биосинтеза протопорфирина IX. [45] |
Страницы: 1 2 3 4