Аспартата
Cтраница 3
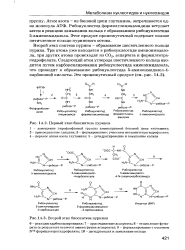
При биосинтезе треонина, метионина и лизина возникат общий для всех этих трех процессов промежуточный продукт - ( 3-семиальдегид аспарагиновой кислоты. Это соединение образуется из аспартата в результате двух последовательно протекающих реакций. Сначала аспартилкиназа катализирует образование р-аспартилфосфата, а затем, на следующем этапе, осуществляемом при участии пиридиннуклеотида, р-аспартилфосфат восстанавливается до альдегида ( фиг. [31]
Подобным образом окисление аспартата может приводить к образованию глутамата через оксалоацетат, цитрат, г мс-аконитат, изоцитрат и а-кетоглутарат. Кетоглутарат акцептирует аминогруппу от аспартата; в результате дезами-нирования аспартата образуется молекула оксалоацетата, которая окисляется до а-кето-глутарата. [32]
Каков будет процент превращения фумарата в аспартат в каждом варианте. Если же используется реакция получения фумарата из аспартата, то при какой исходной концентрации аспартата ( высокой или низкой) процент превращения реагента в продукт будет выше. [33]
Чтобы увеличить содержание лизина в семенах, была предпринята попытка нарушить регуляцию его биосинтеза. Аминокислоты лизин, треонин, метионин и изолейцин синтезируются из аспартата ( рис. 18.16) в несколько этапов. Первый этап состоит в фосфорилировании аспартата аспартаткиназой ( АК) с образованием ( 3-аспартилфосфата. Регуляция обеих ферментативных активностей ( АК и DNDPS) осуществляется с помощью лизина по принципу обратной связи, которую нужно разорвать, чтобы синтез лизина ничем не ограничивался. [34]
Так, пять ферментов осуществляют биосинтез уридин-фосфата из карбамоилфосфата и аспартата. Последние четыре фермента этого процесса репрессируются координированно. [35]
РНК-азы, ДНК-азы и катепсина. При таком расчете на 30 - й день исследования оказалась повышенной и активность аспартат - и аланин-аминотрансфераз. К концу эксперимента активность аспартат-аминотрансферазы нормализовалась, тогда как активность аланин-амино-трансферазы была угнетена. Значительно снизилась и активность карбоксилэстеразы. В то же время активность кетозо-1 - фосфатальдолазы в расчете на 1 г белка мало изменилась. [36]
А-лейцин) ], сохраняют спиральную конформацию даже в дихлоруксусной кислоте, и для перевода этой спирали в неупорядоченное состояние необходима высокая концентрация трифторуксусной кислоты. В то же время не столь прочная спираль поли ( 3-бензил - / - аспартата) становится беспорядочной при добавлении к раствору в хлороформе 10 % - ного количества дихлоруксусной кислоты. Из этих данных следует полуколичественная информация о гидрофобном притяжении между углеводородными боковыми радикалами. [37]
Синтез этих важнейших соединений, входящих в состав нуклеиновых кислот и некоторых коферментов, рассматривается в гл. Процесс тесно связан с функционированием цикла лимонной кислоты: углеродный скелет пиримидинов происходит от аспартата, а атомы азота шестичленных колец пуринов, так же как и атомы азота аминогрупп аминопуринов и ами-нопиримидинов, ведут свое происхождение от аспартата и глутамина. [38]
В дальнейших исследованиях, проведенных с помощью ультрацентрифугирования клеток в градиенте плотности альбумина, было показано, что - облучение крыс в дозе 154 8 мКл / кг снижает активность аспартат - карбамоилтрансферазы тех фракций клеток костного мозга и селезенки крыс, которые в норме характеризуются повышенной активностью этого фермента. Отмечено, что облучение способствует диссоциации регуляторных субъединиц, ингиби-рующих каталитические центры в молекуле аспартат - карбамоилтрансферазы. Присутствие ЦТФ снижает степень угнетения фермента, индуцируемого облучением, но подавляет функциональную активность изолированных каталитических субъединиц молекулы облученного фермента. Bigler и В. М. Tolbert, свидетельствуют о том, что при облучении животных в дозах, близких к летальным, изменение активности этого фермента в тканях не может быть обусловлено прямым или непрямым действием ионизирующих излучений на его молекулы. [39]
В опытах с изотопной меткой была расшифрована сложная схема происхождения пуринов. Два атома углерода поступают из глицина, два - из глутамина и один - из аспартата. [40]
 |
Первый этап биосинтеза пуринов.| Второй этап биосинтеза пуринов. [41] |
Три атома уже находятся в рибонуклеотиде аминоимидазо-ла, три других атома происходят из СО2, аспартата и формилтетра-гидрофолята. Следующий атом углерода шестичленного кольца вводится путем карбоксилирования рибонуклеотида аминоимидазола, что приводит к образованию рибонуклеотида 5-аминоимидазол - 4-карбоновой кислоты. [42]
Центральные пути обмена веществ включают относительно небольшое число превращений. В основном это следующие реакции: триозофосфат пируват; пируват ацетил - КоА; оксалоацетат аспартат; а-кето ( оксо) - глутарат глутамат, а также циклическая система реакций, в ходе которых ацетил - КоА ( С2 на фиг. Последний механизм, известный под названием цикла лимонной кислоты ( ЦЛК), играет столь важную роль в организме, что описанию его посвящена особая глава ( гл. [43]
Биосинтез лизина особенно интересен тем, что для этой цели используются две самостоятельные и различные последовательности реакций. У бактерий, высших животных и у некоторых водорослей и грибов углеродный скелет лизина возникает из пирувата и аспартата с промежуточным образованием а е-диаминопимелиновой кислоты. У других водорослей и грибов источником для синтеза углеродного скелета лизина служат ацетат и а-кетоглутарат, а роль промежуточного продукта в реакции играет а-аминоадипиновая кислота. Общая схема, включающая обе последовательности реакций, представлена на фиг. [44]
Пуриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, в дальнейшем практически не используются, поэтому их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Гринберга экспериментально доказано включение ряда меченых атомов, в частности 15N - и 14С - глицина, 151Ч - аспартата, 151Ч - глутамина и др., в пуриновое кольцо мочевой кислоты. [45]
Страницы: 1 2 3 4