Ионная ассоциация
Cтраница 2
При рассмотрении ионной ассоциации в первую очередь возникает вопрос, когда два соседних противоположно заряженных иона могут быть названы парой. Очевидно, что ионная пара должна существовать достаточно долго, чтобы ее роль как структурной единицы в растворе была ощутима. [16]
Результаты изучения ионной ассоциации в растворе литийзамещенного карборана в ДМЭ также подтверждают сделанное предположение. Межионное расстояние в них ( а), рассчитанное согласно работе [8] по найденной величине Кг, равно 4.1 А. [17]
Интерес к ионной ассоциации не был бы так велик, если бы не далеко идущие последствия этого явления. Ионная ассоциация влияет на электропроводность растворов электролитов, меняет их магнитную восприимчивость и диэлектрическую проницаемость. Появление вблизи заряженной частицы иона противоположного знака вызывает перераспределение электронной плотности в этой частице, что сказывается, в свою очередь, на расположении энергетических уровней. Обнаруживая себя подобным образом, ионная ассоциация дает возможность экспериментатору воспользоваться широким арсеналом физических методов исследования для получения качественной и количественной информации о термодинамических, кинетических и структурных аспектах этого явления. [18]
Электростатическая теория ионных ассоциаций Бьеррума в основном согласуется с экспериментом, однако она содержит и сомнительные положения и ее можно принять только как первое приближение. По этой теории ионы считаются жесткими сферическими частицами, которые могут сближаться на расстояние а, и снижение интенсивности кулоновского взаимодействия вычисляете с использованием макроскопического значения диэлектрической проницаемости. В растворах, содержащих многозарядные ионы, как показано Робинсоном и Стоксом [39], применение макроскопического значения диэлектрической проницаемости оправдано. Так, в растворах 3: 3-электролитов ( например, La [ Fe ( CN) 6 ]) ионы не могут сближаться на расстояния, меньшие 7 2 А, и критическое расстояние образования ионной пары равно 32 1 А. Между сферическими поверхностями с радиусами 7 2 и 32 1 А вокруг ионов содержится примерно 5000 молекул воды, если объем молекулы воды принять таким же ( 30 А3), как в чистой воде. Для ионов 2: 2-электролитов критическое расстояние образования ионной пары - 14 3 А, и внутри оболочки с этим радиусом находится примерно 400 молекул воды. Хотя внутри этих сферических оболочек имеется несколько ионов, временно сближающихся на очень короткое расстояние, большинство их, однако, разделено некоторым числом молекул воды, и только немногие из них находятся в поляризованном состоянии в непосредственной близости от ионов. При этих условиях, возможно, не возникнет большой ошибки в вычислениях с использованием макроскопического значения диэлектрической проницаемости. [19]
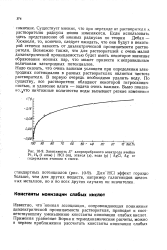 |
Зависимость Е хлорсеребряного электрода ячейки Pt, Нг ( 1 атм НС1 ( т, этанол ( х, вода ( у AgCl, Ag от содержания этанола в смеси. [20] |
Известно, что ионная ассоциация, сопровождающая понижение диэлектрической проницаемости растворителя, приводит к соответствующему уменьшению константы ионизации слабых кислот. [21]
Довольно удачную теорию ионной ассоциации предложил Бьеррум [8,9 ] в 1926 г. Его модель - простейшая из возможных для такой системы. В теории Бьеррума предполагается, что ионы - твердые, неполяризованные сферы, а взаимодействие между ними - кулоновского типа. В качестве дополнительного приближения использована диэлектрическая проницаемость растворителя, хотя необоснованно считать ее величину вблизи иона такой же, как в объеме раствора. Согласно теории Бьеррума, все ионы противоположного знака, находящиеся на определенном расстоянии один от другого, ассоциируются в ионные пары. [22]
Довольно удачную теорию ионной ассоциации предложил Бьер - рум7 - 8 в 1926 г. Его модель - простейшая из возможных для такой системы. [23]
Особенно много внимания ионной ассоциации было уделено в химии карбанионов и анион-радикалов. Здесь с помощью различных физических методов исследования были получены прямые доказательства существования ионных пар различного типа. [24]
Для решения проблемы ионной ассоциации широко используют спектральные измерения. В табл. 3.2 приведен список наиболее важных термодинамических и спектроскопических методов с некоторыми примерами их применения и даны соответствующие ссылки. [25]
Для расчета малых степеней ионных ассоциаций по любому из этих уравнений необходима самая высокая точность экспериментальных результатов и высокая степень надежности уравнений. [26]
Однако наиболее адекватное описание ионной ассоциации можно получить при использовании модельного потенциала, учитывающего как дальнодействующие, так и близкодействующие эффекты. [27]
Представим теперь в виде ионных ассоциаций молекулы других элементов III периода. [28]
Именно на электростатических представлениях теория ионной ассоциации основывалась с самого начала; в литературе до сих пор очень часто встречаются успешные корреляции констант ассоциации ионов с эффективной диэлектрической проницаемостью среды. [29]
 |
Кинетические параметры реакции присоединения этиленоксида к различным нуклеофилам в ТГФ при 25 С. [30] |
Страницы: 1 2 3 4