Атака - нуклеофильный реагент
Cтраница 1
Атака нуклеофильных реагентов направлена в положения 2 и 2 4 4 -дипиридилиевого ядра. [1]
Он предполагает атаку нуклеофильного реагента на атом углерода, несущий заместитель, уходящий в виде нуклеофильной частицы, и дальнейшее изменение переходного состояния не в сторону классического замещения SN2, а в сторону элиминирования. Этот механизм объясняет благоприятное влияние некоторых нуклеофильных агентов на протекание реакции элиминирования. [2]
В этих соединениях атака нуклеофильного реагента направляется на 0-углеродный атом. [3]
В этих соединениях атака нуклеофильного реагента направляется на - углеродный атом. [4]
В результате этого атаке нуклеофильного реагента могут подвергаться 2 4 - й или 6 - й атом углерода. Создавая пространственные трудности для реакции у одних из этих центров, можно направить реакцию в нужную сторону. [5]
В реакциях первого типа атака нуклеофильного реагента направлена на атом серы, что приводит к расщеплению эфира сульфоновой кислоты с регенерацией исходного спирта. В реакциях второго типа атаке подвергается атом углерода, что приводит к расщеплению связи углерод - кислород по 5д 2 механизму. [6]
С вопросом о направлении атаки нуклеофильного реагента тесно связан вопрос и о месте разрыва связи в молекуле субстрата. [7]
Такая молекула способна подвергаться атаке нуклеофильных реагентов, направленной в р-положение. Вероятный механизм цианэти-лирования состоит в следующем. [8]
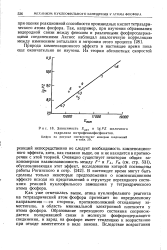 |
Зависимость. акт и IgPZ щелочного гидролиза нитрофенилфосфонатов. [9] |
Как уже отмечалась выше, атака нуклеофильного реагента на тетраэдрический атом фосфора протекает по определенному направлению - со стороны, противоположной отходящему заместителю, в область минимальной электронной плотности у атома фосфора. Образование переходного состояния сопровождается поляризацией связи в молекуле фосфорсодержащего соединения, и заряд на фосфоре имеет тенденцию к возрастанию при отходе заместителя в виде аниона. [10]
Анионы карбоновых кислот не могут подвергаться атаке нуклеофильных реагентов вследствие большой плотности отрицательного заряда на карбоксильной группе. [11]
Изменение строения группы, отщепляющейся в результате атаки нуклеофильного реагента, оказывает влияние не только на скорость реакции и степень замещения продукта реакции, но и на стереохимию процесса замещения. При взаимодействии тозилата и мезилата целлюлозы с ацетатом калия в феноле [11] замещение вторичных тозилоксигрупп протекает через промежуточную стадию образования 2 3-ангидроциклов с последующим их раскрытием и образованием элементарных звеньев альтрозы, в то время как замещение вторичных мезилоксигрупп протекает как типичная реакция межмолекулярного нуклеофильного замещения; образующийся полисахарид содержит в цепи элементарные звенья маннозы. [12]
Все эти реакции имеют то общее, что атака нуклеофильного реагента происходит на атом, связанный кратной связью. Реакции нуклеофильного замещения водорода три насыщенном атоме до сих пор неизвестны. [13]
Как уже отмечалось выше, энергетически наиболее благоприятным направлением атаки нуклеофильного реагента при замещении у насыщенного атома углерода, например в алкилгалогенидах, является атака с тыльной стороны по отношению к уходящему заместителю. Однако переходное состояние при нуклеофильном замещении у атома углерода карбонильной группы в производных карбоновых кислот характеризуется некоторыми особенностями. [14]
Изменяется реакционная способность связанного алкена: он более легко подвергается атаке нуклеофильных реагентов. Практическое значение имеет присоединение воды к этилену в присутствии солей палладия, когда одновременно происходит и окисление с образованием уксусного альдегида ( гл. [15]
Страницы: 1 2 3 4