Коэфициент - активность
Cтраница 2
Величина коэфициента активности / н - зависит от концентрации всех ионов ( а не только одноименных) находящихся в растворе и от их зарядов ( валентности) или, как говорят, от ионной силы раствора. [16]
Понятие коэфициента активности необходимо для более точного-определения электродных потенциалов и электродвижущих сил. [17]
Зависимость коэфициента активности мембраны ам от ее конструкции и установки: г - радиус обжимных дисков; R - радиус мембраны; 1 - плоская мембрана без дисков; 2 - плоская мембрана с дисками; 3 - мембрана с канавкой и дисками; 4 - трапецеидальная мембрана с дисками; 5 - гармоникообразиая мембрана. [18]
Значения коэфициентов активности тройных смесей, предсказанные путем линейной интерполяции кривых бинарных систем при выражении концентрации через молярные доли, не приводят к предсказанной на основании экспериментальных данных величине общего давления. [19]
Так как коэфициент активности ионов убывает с увеличением ионной силы от 0 до 0 1, то ясно, что Кс увели-чится. [20]
Вообще же коэфициенты активности ионов электролита уменьшаются с увеличением концентрации, раствора ( em ионной силы), проходят через минимум и затем ] снова возрастают. [21]
Численная величина коэфициента активности зависит от двух факторов: выбора стандартного состояния для активности и единиц, в которых выражены концентрации. Выбор стандартного состояния диктуется удобством расчета в каждом отдельном случае. [22]
Экспериментальное определение коэфициентов активности сложно, и потому заслуживающие доверия цифры получены только для сравнительно простых случаев. В тех же случаях, с которыми мы обычно имеем дело при анализе, когда в растворе присутствуют несколько разных солей с ионами различной валентности и к тому же в сравнительно больших концентрациях, пользоваться коэфициентами активности в настоящее время не представляется возможным. Поэтому в дальнейшем для сильных электролитов мы будем вместо активностей ионов употреблять их концентрации, вычисленные исходя из допущения 100 % - ной диссоциации сильных электролитов в растворах. Сделанные таким образом расчеты являются, конечно, неточными, но качественно они обычно хорошо согласуются с опытом и очень наглядно иллюстрируют смысл и значение отдельных положений теории. [23]
 |
Приближенные значения коэфициентов активности. [24] |
Приводим значения коэфициентов активности этих ионов. [25]
Наши здания коэфициентов активности при различных условиях весьма скудны. [26]
Замена ими коэфициентов активности, что часто делается, всегда вводит в расчет некоторую ошибку, растаюшую с концентрацией. [27]
V) определяем коэфициент активности СО2 при 25 С. Он составляет около 82 % и, следовательно, реальное давление СО2 равно приблизительно 36 атм. [28]
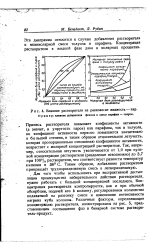 |
Влияние растворителя на равновесие жидкость - пар. Пример. влияние добавления фенола к смеси парафин - толуол. [29] |
Примесь растворителя повышает коэфициенты активности ( а значит, и упругость паров) как парафина, так и толуола, но коэфициент активности первого повышается значительно в большей степени, и таким образом относительная летучесть, которая пропорциональна отношению коэфициентов активности, возрастает с молярной концентрацией растворителя. Так, например, относительная летучесть увеличивается от 1 0 при нулевой концентрации растворителя ( разделение невозможно) до 3 7 при Ю0 / 0 растворителя, что соответствует разности температур кипения в 36 С. Таким образом, добавление растворителя превращает трудноразделяемую смесь в легкоразделимую. [30]
Страницы: 1 2 3 4