Коэфициент - активность
Cтраница 4
Приводимые в литературе таблицы коэфициентов активности электролитов содержат именно эти значения с. При отсутствии данных о зависимости коэфициента активности от температуры в первом приближении можно считать, что он не зависит от температуры, если температурный интервал не слишком велик; наоборот, он очень заметно изменяется с концентрацией электролитов в растворе, но сохраняет приблизительно одно и то же значение для всех растворов с одинаковой ионной силой. [46]
Теперь с помощью значений коэфициентов активности отдельных ионов, приведенных в таблице 11, находим значения. [47]
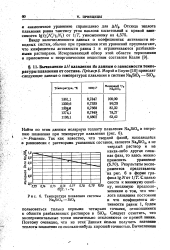 |
Температура плавления системы NasSiOj - SiOa. [48] |
Ввиду малочисленности данных о коэфициентах активности неводных систем, обычно при применении этих уравнений предполагают, что коэфициенты активности равны 1 и ограничиваютсях разбавленными растворами. [49]
В соответствии с этим уравнением коэфициенты активности газов должны быть некоторой универсальной функцией приведенной температуры и приведенного давления и не должны зависеть от природы данного газа постольку, поскольку можно считать, что все газы подчиняются одному и тому же уравнению состояния. На этом основании были составлены [1] графики зависимости отношения у / / Р от приведенного давления при различных значениях приведенной температуры. При построении графиков были использованы экспериментальные данные по соотношениям Р - V - Т для ряда самых различных газов. Хотя такие графики не слишком точно описывают поведение любого газа при любых условиях, однако для большинства расчетов определяемые таким путем величины вполне приемлемы. [50]
Следует отметить однако, что коэфициенты активности ионов Н ( точнее Н3О) и NO. Возрастание активности с увеличением ионной силы, которое после перехода за минимум наблюдается у всех ионов, наступает для ионов водорода раньше, чем для других ионов. Нитрат-ионы, наоборот, имеют активности меньшие, чем данные в таблице. [51]
Влияние присутствия посторонних ионов на коэфициенты активности сильных электролитов может быть иллюстрировано следующими примерами. В концентрированном растворе хлорида щелочного металла хлористый водород обнаруживает большую концентрацию активного водорода, чем тот же хлористый водород в чистой воде. Уксусная кислота является более сильной кислотой в присутствии большого количества хлористого натрия. Этот факт интересен потому, что прибавление ацетата натрия к раствору, содержащему водородные ионы, приводит к уменьшению концентрации последних вследствие образования недиссоциированных молекул уксусной кислоты. [52]
Аналогичное выражение можно написать для коэфициента активности активированного комплекса, имеющего заряд, одинаковый с А. [53]
Коэфициент активности аниона принимается равным коэфициенту активности водородного иона. Коэфициент активности незаряженной, неионизированной уксусной кислоты не должен заметно отличаться от единицы. [54]
Страницы: 1 2 3 4