Атом - рутений
Cтраница 3
С в атмосфере инертного газа приводит к потере ими высоких каталитических свойств и образованию катализаторов, ведущих себя аналогично платине. Это явление объяснено диффузией атомов рутения из поверхностного слоя в объем. Такое ж & объяснение влиянию термообработки на свойства сплавов дана Дамьяновичем и Брузиком [244], исследовавшими сплавы платины и палладия с золотом при электровосстановлении кислорода. Филштихом [224] предложен платино-палладиевый катализатор для окисления метанол-формиатной смеси в щелочных растворах, получивший практическое применение. [31]
В отличие от бис - ( я-бензол) хрома ( IX), в котором сохраняются ось симметрии шестого порядка и плоская конфигурация бензольных ядер, в структуре XXI одно из бензольных колец искажено. Природа искажения понятна из правила 18 электронов: атом рутения дает восемь электронов, шесть электронов дает одно бензольное кольцо, а второе кольцо координируется лишь за счет двух я-связей, вносящих четыре электрона. [32]
Данная подгруппа состоит из элементов железа, рутения и осмия, атомы которых относятся к d - типу. В связи с провалом одного s - электрона в атоме рутения число d - электронов у него на единицу больше, чем у атомов железа и осмия. Валентность же рутения и осмия может быть доведена до 8 за счет возбуждения парных электронов на более высокие энергетические подуровни. [33]
Расстояние Ru-Ru равно 2 685 0 002 А. Фрагмент Ru2 ( CO) 6 имеет симметрию - mm; каждый атом рутения связан с тремя карбонильными группами, расположенными примерно перпендикулярно друг другу. [34]
Они принадлежат к очень близкому, но слегка деформированному структурному типу. Атомы брома образуют гексагональную плотнейшую упаковку, в 1 / 3 октаэдриче-ских пустот которой расположены атомы рутения. Мотив заполнения пустот таков, что вдоль с-оси кристалла образуются цепочки октаэдров, связанных по граням. Все атомы брома мостиковые. В отличие от TiJ3, в данном случае атомы металла распределены неравномерно вдоль цепи: они находятся на расстояниях 2 73 и 3 12 А друг от друга. [35]
Реальная ситуация более сложна, поскольку координата X зависит от всех лигандов и электронов комплекса. В зависимости от того, насколько близко расположены металлические центры и насколько велико перекрывание орбиталей ( по одной на каждом атоме рутения), те две орбитали, на которых может находиться неспаренный электрон, в состоянии смешиваться с образованием связывающей и разрыхляющей комбинаций. Это должно приводить к картине, изображенной на рис. 10.27 5 или В. Согласно рис. 10.27 В, неспаренный электрон полностью делокализован в любой момент времени, а электронное поглощение нельзя по-настоящему назвать переносом электрона между двумя центрами с различной степенью окисления. [36]
К элементам этого ряда относятся железо, рутений и осмий. Атомы железа и осмия имеют во внешнем слое 2 электрона и на соседнем с ним) 8 6) электронов, а у атома рутения имеются соответственно 1 и) 8 7) электронов. [37]
К элементам этого ряда относятся железо, рутений и осмий. Атомы железа и осмия имеют во внелнем слое 2 электрона и на соседнем с ним) 8 - j - 6) электронов, а у атома рутения имеются соответственно 1 и) 8 - т - 7) электронов. [38]
Атомы рутения образуют кластер и расположены по вершинам тригональной пирамиды; азуленовый лиганд присоединен к ее основанию. Средняя длина связи Ru - Ru в основании пирамиды равна 2 89, до вершинного атома Ru ( 4) 2 75 А. Атомы рутения имеют различную координацию. Вершинный атом Ru ( 4) не участвует в связях с азуленовым лигандом. [39]
Изучена возможность применения соединений рутения для гидрирования аренов, в частности для частичного восстановления бензола. Бис ( гексаметилбензол) рутений ( 0) [ Ки - МевСбЬ ] гидрирует бензол до циклогексана при 90 С и 2 - 3 атм [76], однако полная г ис-селективность при этом не наблюдается, что указывает на возможность присутствия ненасыщенных соединений, образующихся при распаде металлических комплексов. При восстановлении бензола до циклогексана на 1 атом рутения восстанавливалось 9000 молекул бензола. Этот катализатор восстанавливает ароматические простые эфиры, спирты, сложные эфиры, вторичные амины, однако галогенбензолы восстанавливаются с трудом, причем наблюдается частичное дегалогенирование. Гидрирование дифенилового эфира представляет собой трудную задачу, нитробензол восстанавливается лишь до анилина. [40]
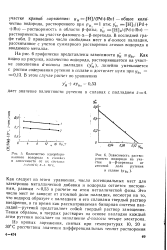 |
Количество адсорбированного водорода в сплавах в зависимости от их состава.. - / Ю С. 2 - / - - З0 - с.| Зависимость растворимости водорода на участке а-р-перехода от атомной доли рутения. [41] |
Как следует из этого уравнения, число потенциальных мест для электронов металлической добавки и водорода остается постоянным, равным - 0 53 в расчете на атом металлической фазы. Это число мест не зависит от атомной доли палладия, несмотря на то, что водород образует с палладием и его сплавами твердый раствор внедрения, в то время как рассматриваемая бинарная система палладий-рутений представляет собой твердый раствор замещения. Таким образом, в твердых растворах на основе палладия каждый атом рутения посылает на заполнение - полосы четыре электрона. [42]
В кубических кристаллах б с-бензолхрома атом хрома также является центром симметрии молекулы. I) колец, а в ферроцене - к скошенной конфор-мации ( II), тогда как аналогичные соединения - дициклопен-тадиенилрутений ( III) [75] и дициклопентадиенилосмий [83] - имеют заслоненную конформацию в своих орторомбических кристаллах. Одной из причин такого их отличия от ферроцена могут быть большие размеры атомов рутения и осмия, что уменьшает отталкивание между атомами водорода различных колец. [43]
Два таких октаэдра, связанные по ребру, образуют димер. Симметрия молекулы близка к C2h, но сами Ru-О ктаэдры довольно сильно деформированы. Максимальное отклонение от 90 наблюдается у угла Sn ( i) - Ru-Srid / ( 108 5), что вызвано, по-видимому, взаимодействием между атомами рутения. Соответствующее расстояние Ru-Ru равно 3 116 А. [44]
 |
Расстояния Ru-Hal и Ru-Ru в простых галогенидах рутения. [45] |
Страницы: 1 2 3 4