Р-углеродный атом
Cтраница 3
Эффекты замещения при а - и р-углеродных атомах также развиваются по обоим отмеченным направлениям: изменение валентных углов и электронное взаимодействие с полярными заместителями. Отмечается [21, 80, 103] благоприятный эффект а-метильного, а р-циклоалкильного и даже р р-геж-диметиль - floro замещений у реакционного центра, изменяющих соответствующим образом конформацию молекулы исходного галоидал-жиламина или аминоалкилсульфата. [31]
Однако не все исходные а - и р-углеродные атомы алкеновой группы переходят в циклическое четырехчленное кольцо. [32]
Однако не все исходные а - и р-углеродные атомы алкеновой группы переходят в циклическое четырехчленное кольцо. [33]
Алкоголяты металлов, имеющие стабилизирующую анионгруппу у р-углеродного атома, подвергаются реакции расщепления, при которой доноры протонов в растворителе служат в качестве электрофилов. Легкость расщепления зависит от природы заместителя, связанного с атомом углерода, у которого протекает замещение. Такие группы, как карбонил, нитро, циано и сульфо, являющиеся хорошими акцепторами электронов, очень сильно облегчают процесс расщепления. Если активирующей группой служит арил, необходимы более жесткие условия в отношении температуры и силы основания. [34]
Отрыв алкана включает отрыв атомов водорода от р-углеродного атома. Эта реакция протекает, видимо, с образованием промежуточных продуктов - карбена или соединений, содержащих фрагмент Ti - СН2 - Ti. Перенос протона от одной алкильной группы к другой протекает с участием переходного металла. Для того чтобы эта реакция шла, переходной металл должен иметь вакантное место. Скорость элиминирования алкана под действием оснований Льюиса увеличивается благодаря тому, что они повышают координационное число центрального атома. В пяти - или шестикоординационных комплексах степень перекрывания орби-талей переходного металла и углеродного атома в алкильной группе уменьшается. Это приводит к дестабилизации связи Me-С. [35]
Отсюда следует, что анион подходит к р-углеродному атому под прямым углом к плоскости, образованной координатами атомов, составляющих еноновую систему. [36]
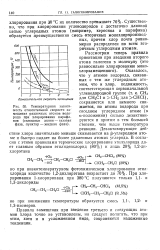 |
Температурная зависимость относительной скорости замещения различных атомов водорода при хлорировании парафинов ( сплошные линии - газовая фаза, пунктир - жидкая фаза. [37] |
Дезактивирующее действие хлора значительно меньше сказывается на р-углеродном атоме и быстро падает на более удаленных атомах углерода. [38]
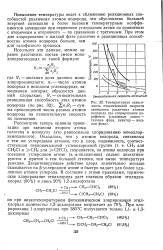 |
Температурная зависимость относительной скорости замещения различных атомов водорода при хлорировании парафинов ( сплошные линии - газовая фаза, пунктир - жидкая фаза. [39] |
Дезактивирующее действие хлора значительно меньше сказывается на р-углеродном атоме и быстро падает для более удаленных атомов углерода. [40]
СС связи, тем меньше электрофильная реакционная способность р-углеродного атома и тем вероятнее, что реакция начнется с атаки более нуклеофильного иона ОН [25 18], Соответственно, в уравнении для скорости реакции слагаемые в первой его части будут связаны другим соотношением: k [ sJ [ H2OJ3C [ s ] [ Olfj, т.е. основной вклад будет принадлежать второму слагаемому. [41]
Здесь влияние метильных групп у а - и р-углеродных атомов, очевидно, уравновешивает друг друга, а потому присоединение НВг, как и в случае самого винилсилана, проходит вопреки правилу Марковникова. Изучение присоединения НВг к двойным связям, находящимся в у - и 6-положении к атому кремния, показало [118, 135], что в обоих случаях присоединение идет по правилу Марковникова. Таким образом, чередование зарядов, способных обращать порядок присоединения НВг в ряду нормальных алкенилсиланов, заканчивается уже на двойной связи, находящейся в р-положении. Однако по данным физических исследований чередование зарядов по знаку, правда, постепенно затухающее по величине зарядов, распространяется и далее. [42]
При метаболизме алканов микроорганизмами происходит в основном окисление р-углеродного атома. По-видимому, здесь идет микробиологическое окисление по схеме реакции Байера - Виллигера. Следы ацетата ундеканола-1, обнаруженные при превращении тридеканола-2 в ундеканол-1 под действием Pseudomonas multivorans [3], как будто подтверждают этот механизм, однако данных для окончательного вывода пока недостаточно. [43]
Они показали, что тритий, связанный с р-углеродным атомом, отщепляется примерно в 7 раз медленнее протия. Это свидетельствует о том, что связи в переходном состоянии в значительной степени разорваны. [44]
Страницы: 1 2 3 4