Лабильный атом
Cтраница 2
Далее, Зильберман Е. М. [195] показал возможность взаимодействия ЭФК с лабильными атомами хлора с образованием фосфорилированного полимера, обладающего повышенной термостабильностью, а также отмечен синергизм солей жирных кислот с органическими фосфитами за счет образования солен моноалкилфосфористых кислот. [16]
В отличие от протогенных растворителей в состав ДАР не входят лабильные атомы водорода. Поэтому они являются относительно слабыми кислотами. Некоторые ДАР обладают четко выраженными основными свойствами. Например, ДМСО является более сильным основанием, чем вода и пиридин. [17]
Согласно этой схеме, выделяющиеся на электроде атомы Н реагируют с лабильным атомом водорода катализатора быстрее, чем с ионами гидроксония ( для простоты везде пишем Н), вследствие чего реакция с катализатором способствует снижению перенапряжения. Адсорбированный анион В быстро реагирует с ионами гидроксония или другими донорами протонов из буферной смеси с регенерацией катализатора. Следовательно, катализатор служит здесь только как переносчик протона и непосредственно с электронами не реагирует. [18]
Как общее правило, эти реакции в едут к образованию гидрида с менее лабильным атомом водорода, и соответственно этому по порядку идут: метан, аммиак, ацетилен и вода. Равновесие в этих реакциях сдвигается вправо, и обмен практически протекает нацело. Подобные же результаты были получены для аналогичных соединений всех более электроположительных металлов, но ковалентные соединения некоторых менее положительных металлов таким путем не реагируют. Ряд слабоотрицательных анионов и соответственных гидридов легко может быть интерполирован и расширен; например, многие арильные группы занимают положение между алькильными группами и аминогруппой, в то время как оксирадикалы спиртов и фенолов, по-видимому, способны замещать этинильную группу, а амино - и иминогруппы должны быть помещены либо выше, либо ниже этинильной группы, в зависимости от связанных с ними радикалов. Составление таких рядов имеет значение для предвидения реакций замещения в ацетилене. [19]
Несколько ранее были описаны реакции окисления растворенным при помощи краун-эфиров К02 соединений с лабильным атомом водорода, таких, как дигидроантрацен, гексадиен-1 3, гексадиен-1 4, антролин, ксантен и ди-фенилметан [ схема (4.43) ] [ fi2 ], а также реакция аниона гидропероксида ирей-бутила [ 63], реакции с фенильными радикалами [ 64], использование спиновых ловушек для идентификации радикалов алкилпероксидов из алкилгалоге-нидов [ 65], а также реакции окисления алкилзамещенных фенолов [ 66] и отрыва водорода. [20]
Несколько ранее были описаны реакции окисления растворенным при помощи краун-эфиров К02 соединений с лабильным атомом водорода, таких, как дигидроантрацен, гексадиен-1 3, гексадиен-1 4, антролин, ксантен и ди-фенилметан [ схема (4.43) ] [ fi2 ], а также реакция аниона гидропероксида трет-бутила 163 ], реакции с фенильными радикалами [ 64], использование спиновых ловушек для идентификации радикалов алкилпероксидов из алкилгалоге-нидов [ 65], а также реакции окисления алкилзамещенных фенолов [ 66] и отрыва водорода. [21]
Сернистая сенсибилизация эмульсии протекает в две стадии: 1) молекула сенсибилизатора с лабильным атомом серы адсорбируется на поверхности кристалла галогенида серебра около мест дислокаций и 2) в результате разложения адсорбционных комплексов образуется адсорбированный сульфид серебра. [22]
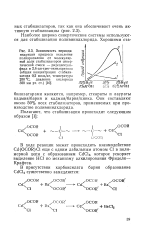
В ходе реакции может происходить взаимодействие Cd ( OCOR) Cl еще с одним лабильным атомом С1 в полимерной цепи с образованием CdCl2, которое ускоряет выделение НС1 по механизму алкилирования Фриделя - Крафтса. [24]
Относительная стабильность р-формы D-глюкозы в водном растворе была приписана экваториальной конформации гидр-оксильной группы при лабильном атоме углерода ( Reeves, 1951; ср. [25]
Действие кислорода, как уже подробно разбиралось выше, обусловлено в большинстве случаев легкостью отрыва лабильных атомов водорода и образованием нестабильных кислородсодержащих продуктов, способствующих развитию разветвленного цепного процесса. Кроме того, эти продукты ( вода, спирты, кислоты и др.) при разрушении поликонденсационных соединений оказывают дополнительное деструктирую-щее действие. [26]
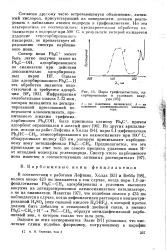 |
Пары трифенилметана, адсорбированные в условиях вакуума. [27] |
Согласно другому часто встречающемуся объяснению, активный кислород, присутствующий на поверхности, должен реагировать с лабильным атомом водорода в трифенилметане. [28]
Другим возможным способом введения в полимерную цепь химически связанного лития является реакция обмена между литийалкилами и лабильным атомом водорода ароматических ядер. [29]
Представление о возможности обратимого окисления - дегидрирования хлорофилла основывалось преимущественно на данных о наличии в молекуле хлорофилла лабильного атома водорода у 10-го атома углерода. [30]
Страницы: 1 2 3 4