Отрицательный атом
Cтраница 1
Наличие отрицательного атома кислорода делает карбоксилат-анион способным анхимерно участвовать в реакциях замещения. Хорошо известно, что тип продуктов, получаемых при обработке галогенсодержащих кислот щелочью, зависит от относительного расположения атома галогена и карбок-силат-группы в анионе кислоты. Если карбоксигруппа находится в а - или 3-положении по отношению к галогену, то продуктом реакции будет оксикисло-та, хотя р-оксикислота может далее превращаться в а р-непредельную кислоту при отщеплении воды. [1]
Наличие отрицательного атома кислорода делает карбоксилат-анион способным анхимерно участвовать в реакциях замещения. Хорошо известно, что тип продуктов, получаемых при обработке галогенсодержащих кислот щелочью, зависит от относительного расположения атома галогена и карбок-силат-группы в анионе кислоты. Если карбоксигруппа находится в а - или Р - положении по отношению к галогену, то продуктом реакции будет оксикисло-та, хотя р-оксикислота может далее превращаться в а р-непредельную кислоту при отщеплении воды. [2]
При этой реакции выделяется отрицательный атом водорода, который должен отдать свои электроны, то-есть окислиться. Окисление происходит за счет кислорода воздуха или за счет других молекул нитробензола. [3]
 |
Потенциальный барьер, обусловленный поверхностными состояниями. [4] |
Особенно интересен случай адсорбции сильно отрицательных атомов кислорода, приводящий к образованию инверсионного р-слоя на поверхности электронного германия. [5]
Поэтому водород присоединяется к отрицательному атому углерода а галоген - к положительному. Если значения электроотрицатель ности заместителей в молекуле одного и того же порядка, в резуль тате реакции присоединения получается смесь изомеров. [6]
Показано, что накопление каких-либо отрицательных атомов и групп в молекуле кислородсодержащего органического соединения приводит к упрочению связей этих атомов и групп с соответствующими атомами углерода. Это упрочение связей определяет относительную легкость пинаколиновои перегруппировки а-гликолей, относительную легкость образования сложных зфиров спиртов и дегидратации спиртов и ( Ь - оксикислот, возможность существования и устойчивость 1 1-диолов и 1 1 1-триолов, существование и относительную легкость гидролиза ацеталей, кеталей, полуацеталей и хлорацеталей, подвижность атома галоида в галоидангидридах кислот, константу кислотной диссоциации водородистых соединений, возможность существования галоидгидринов 1 1-диолов. [7]
Результирующий положительный заряд атома водорода притягивается отрицательным атомом азота. Эти связи достаточно прочны для того, чтобы заметно сказаться на температурах плавления и кипения. [8]
Растворители с атомами водорода, связанными с более отрицательными атомами ( кислородом, серой, азотом, галогенами), образуют водородные связи с акцепторами протонов и быстро обменивают атомы водорода на дейтерий. [9]
В них водород соединен с кислородом ( или с другим отрицательным атомом) нормальной валентностью и не способен отщепляться в виде иона. [10]
Выходило, что положительные атомы водорода в юске заместились отрицательными атомами хлора, но это так мало изменило свойства воска, что он попреж - 1ему годился для изготовления свечей. [11]
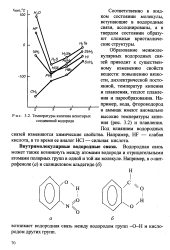 |
Температуры кипения некоторых соединений водорода. [12] |
Водородная связь может также возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле. [13]
 |
Схема диссоциации молекулы электролита под действием молекул воды. [14] |
При этом молекулы воды через водородный атом связываются с наиболее отрицательными атомами других молекул или, наоборот, связываются с водородным атомом другой молекулы, если он несет достаточно положительный заряд. [15]
Страницы: 1 2 3 4