Мольная доля - вещество
Cтраница 3
После окончания итерационной процедуры управление передается строке 9000, в которой вычисляется мольная доля легкокипящего вещества в газовой фазе. В строках 9100 и 9130 на экран выводятся следующие величины: мольная доля легкокипящего вещества в газовой фазе и жидкости, соответствующая температура кипения и порядковый номер тарелки. В строке 9200 проверяется, для всех ли тарелок выполнен расчет. Если рассмотрены еще не все тарелки и условие, записанное в операторе IF, не выполняется, то в строке 9300 состав жидкой фазы на следующей тарелке приравнивается составу газовой фазы на предыдущей тарелке. Одновременно счетчик тарелок 15 увеличивается на единицу и управление передается строке 2100, с которой начинается очередная процедура вычисления температуры кипения смеси на соответствующей тарелке. [31]
По закону Генри р kX, где р - давление пара вещества над его раствором, X - мольная доля вещества, k - постоянная. [32]
А и В, которая контактирует с нелетучей жидкостью С, и предположим, что жидкость С способна абсорбировать только вещество А. Профили концентраций в обеих фазах указанной системы изображены схематически на рис. 20 - 6, где через у А обозначена мольная доля вещества А в газовой фазе, а через ХА - мольная доля того же вещества в жидкости. [34]
Пайка оловяино-свинцовыми припоями, как и пайка свинцом, сопровождается выделением свинца в воздух производственных помещений. Теоретически при испарении жидкостей концентрация паров металлов q над их поверхностью определяется по формуле 1600 / Мл / ( 273), где М - молекулярная масса вещества; п - мольная доля вещества в растворе; t - температура раствора, С; Я - давление насыщенного пара над поверхностью жидкого припоя. [35]
В зоне существования пара происходит переход легких фракций сырой нефти [3.22], [3.23] в газовую фазу. Этот эффект становится заметным только после прокачки больших объемов пара, так как молекулы легких углеводородов переходят в газовую фазу с поверхностей раздела жидкости и пара только после перемещения в объеме смеси жидких углеводородов к поверхности раздела вследствие молекулярной диффузии или гидродинамической дисперсии. Поэтому соотношение мольных долей веществ в жидкой и газовой фазах в этом случае отличается от их соотношения при термодинамическом равновесии. [36]
Метод основан на измерении разности температур капель раствора исследуемого вещества и растворителя, помещенных в атмосферу насыщенного пара этого же растворителя. В результате разности упругости паров над чистым растворителем и над раствором происходит конденсация паров растворителя в раствор. За счет выделяющейся при этом теплоты возникает разность температур, пропорциональная мольной доле растворенногэ вещества. [37]
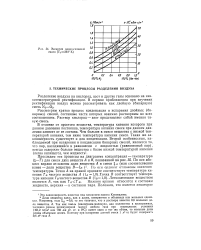 |
Эксергия неоно-гелиевой смеси ( Г0 293 К. [38] |
Эта закономерность известна под названием закона Коновалова. Доли вещества здесь, как и далее, измеряются в объемных или мольных единицах. Например, если А 0 6, то это означает, что в растворе имеется 0 6 мольных доли вещества А. Так как кмоль ( килограмм-молекула, или количество в килограммах, численно равное молекулярной массе) любого газа при нормальных условиях ( 101 2 кк / ж2 или 760 мм рт. ст. и 0 С) имеет один и тот же объем, то мольные доли равны объемным долям. [39]
В рассматриваемом случае имеются два компонента и две фазы: одна - жидкая, другая - паровая, так что число степеней свободы равно двум. Если заданы температура разгонки и состав, то этим будет определено общее давление. В простейшем случае отношение давления пара компонента такой смеси к давлению пара этого же вещества в чистом виде определяется мольной долей вещества в жидкой смеси. Смеси, для которых применимо это простое соотношение, называются идеальными, а само соотношение известно как закон Рауля. [40]
Уравнение ( 4) качественно описывает указанный выше ход изотермы растворимости вещества в газе. Из нето следует, что при данной температуре величина изменения содержания вещества в газовой фазе от давления определяется разностью молярных объемов вещества в обеих фазах. Поэтому производная din N2 / dP является отрицательной, и кривая идет вниз. Этой области давлений соответствует увеличение мольной доли вещества в газовой фазе. [41]
Смесь конденсируемого газа А с неконденсируемым газом В движется по трубе, в которую вставлены два длинных цилиндрических термометра. Один из них, называемый сухим, непосредственно контактирует своими стенками с газовым потоком, тогда как на другой термометр, называемый влажным, надет фитиль, пропитанный жидкостью А. Под действием капиллярных сил свежая жидкость А непрерывно поступает на стенку влажного термометра из резервуара, расположенного внизу. Требуется вывести уравнение, связывающее мольную долю вещества А в газовом потоке с показаниями влажного и сухого термометров. [43]
Это выражение описывает процесс медленного массообмена между стенкой трубы и потоком жидкости или газа, движущимся по данной трубе. Мольная доля хАо вещества А на границе раздела фаз принята постоянной по всей длине L поверхности массообмена. Массопере-дача может возникать вследствие испарения, конденсации, растворения, кристаллизации, в результате протекания каталитической реакции на стенке трубы, а также по ряду других причин. В уравнении (20.9) через ХАЫ обозначено среднее по потоку объемное значение мольной доли вещества А на входе в массообменную секцию аппарата. В последующих разделах введены и обсуждены другие понятия, важные для характеристики систем со сложной геометрией. [44]
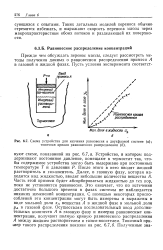 |
Схема устройства для изучения равновесия в двухфазной системе ( а. типичная кривая равновесного распределения ( б. [45] |
Страницы: 1 2 3 4