Ауверс
Cтраница 3
Парахор [79] и закон Ауверса - Скита приводят к заключению, что продукт, полученный из ( -) - ментопа, представляет собой m / оаис-изомер, а соединение, полученное из пзоменто-на - ifuc - изомер. [31]
Получение в этих условиях Ауверсом и Мауссом исключительно а а-ди-фенилпропиленгликоля можно понять только при допущении, что авторы работали с а-кетолом, содержащим значительные количества не омылившегося при его приготовлении ацетата. [32]
Очевидно из предыдущего, что Ауверс и Мейер здесь неточно излагают точку зрения Вислиценуса. [33]
Преимущество своей формулы перед Армстронговской Ауверс видит прежде всего в том, что она соответствует принятой им для нафталина, который, как уже сказано выше, по своему спектрохиЧническому характеру близок к антрацену. На основании ее понятно, что заместители - алкилы или галогены - равномерно понижают экзальтации у преломляющей способности исходного вещества, тогда как при принятии формулы IV для этого нужно было бы допустить добавочную гипотезу о том, что каждое замещение происходит сначала в олефиновой части молекулы. [34]
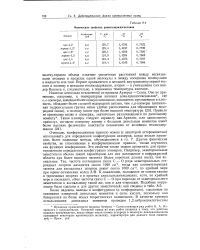 |
Физические свойства диметилциклогексанов. [35] |
Известно несколько исключений из правила Ауверса - Скита. [36]
В настоящее время формулировка правила Ауверса - Скита изменилась и звучит так [9]: в паре изомерных двуза-мещенных циклогексанов более низкую температуру кипения, показатель преломления и плотность имеет изомер с диэква-ториальной ориентацией заместителей, В такой форме правило применимо и к 1 3-изомерам, к изомерным метилцикло-гексиламинам [10] и другим производным циклогексана. [37]
Таким образом, из наблюдений Ауверса следует вывести то заключение, что современные формулы строения флуорена идифе-нила не отвечают всем их свойствам и поэтому тонкая структура энх соединений ими не выражается. К сожалению, Ауверс не дает для них новых формул, которые более отвечали бы его взглядам. [38]
В настоящее время формулировка правила Ауверса - Скита изменилась и звучит так [9]: в паре изомерных двуза-мещенных циклогексанов более низкую температуру кипения, показатель преломления и плотность имеет изомер с диэква-ториальной ориентацией заместителей. В такой форме правило применимо и к 1 3-изомерам, к изомерным метилцикло-гексиламинам [10] и другим производным циклогексана. [39]
Стереохимия этих реакций была исследована Ауверсом [326] на примере присоединения диазометана к метиловым эфирам диметилмалеиновой и диме-тилфумаровой кислот. Автор получил изомерные Д пиразолииы, в которых сохранилось первоначальное расположение цис - и тпранс-конфигураций карбоксильных групп. [40]
Но в таком случае, говорит Ауверс, спектрохимические отношения нафталина становятся непонятными, потому что эта небольшая разница в состоянии бензола и нафталина не может обусловливать глубокого оптического различия между ними. Кроме того, Бамбергеровское трактование степени насыщения валентностей в формуле нафталина плохо согласуется со спектрохимическими наблюдениями. Ауверс поэтому считает его невероятным. [41]
Схема такого типа была впервые предложена Ауверсом [64- 68] для реакции алкилирования основаниями Манниха, полученными из фенолов. [42]
Липп [28], а затем более подробно Ауверс и Ашан [29, 30] указали, что эта характерная особенность структуры камфена заметно отражается на его оптических свойствах. Дело заключается в следующем. [43]
В 1921 г. Штайгер, Хюккель и Ауверс опубликовали работы, посвященные проблеме связевых рефракций. [44]
Карл Циглер, который был аспирантом Карла фон Ауверса в Университете Марбурга, является пионером органометаллической полимеризации. Было известно, что такие металлы, как натрий, способны полимеризовать бутадиен и другие подобные мономеры. [45]
Страницы: 1 2 3 4