Ацилфермент
Cтраница 1
Ацилфермент представляет собой сложный эфир, образованный, как было показано химическими и физическими методами, путем присоединения ацильного фрагмента молекулы субстрата к остатку Ser-195 фермента. [1]
Реагируя с ацилферментом, нуклеофил находится в прото-нированном состоянии, на что указывает характер рН - за-висимости реакции ацетил -, изопропоксифосфонил - и диме-тилфосфорилхимотрипсина с нуклеофильными агентами: изонитрозоацетоном, глицингидроксамовой и фенилацето-гидроксамовой кислотами. [2]
Для механизма (4.10) ацилфермент является промежуточным соединением в механизме катализа, в случае схемы (4.11) происходит специфическое ингибирующее ацилирование активного центра. [3]
Образование и гидролиз ацилфермента ( ацилирование и де-ацилирование фермента) можно изучать отдельно, при соответствующим образом подобранных условиях или субстратах. [4]
В случае специфических субстратов промежуточный ацилфермент - весьма нестабильное соединение ( время жизни - 0 01 с) [26], которое гидролизуется под действием воды с образованием кислоты и регенерацией свободного фермента. [5]
По данным кинетики метанолиза ацилфермента реакция имеет первый порядок по нуклеофилу. [6]
Таким образом, образование ацилфермента в качестве интер-медиата в реакции гидролиза - нитрофенилацетата кинетически доказано. [7]
Цис - и граяс-изомеры ацилферментов коричной и нитрокорич-ной кислот были выделены в индивидуальном виде, изучены их спектральные характеристики, процесс цис-гранс-фотоизомеризацйи циннамоильных групп в активном центре химотрипсина, исследована кинетика гидролиза. В табл. 11 приведены кинетические характеристики цис и грамс-изомеров субстратов в реакции ацилирования ( k2 / Ks) и деацшшрования образующихся ацилферментов. Видно, что траяс-стереоизомеры в 103 - 104 раз более реакционноспособны, чем соответствующие цыс-формы. [8]
 |
Зависимость константы скорости деацилиро-вания ацилферментов - производных алифатических карбоновых кислот от гидрофобности алифатического радикала. / - СН3, 2. [9] |
Ацетамидная группа для всех обсуждаемых ацилферментов в 250 раз увеличивает скорость гидролиза. Это соответствует понижению свободной энергии активации на 3 3 ккал / моль. [10]
Структура и реакционная способность ацилферментов алифатических карбоновых кислот и М - ацетил - Ь - аминокислот. Интересные выводы о природе ферментативного катализа могут быть сделаны при систематическом изучении реакционной способности ацилферментов, различающихся числом СН2 - звеньев в структуре ацильной части. [11]
Хотя доказательства механизма с образованием ацилфермента весьма многочисленны, существует лишь немного четких указаний на то, что центром ацилирования является гидроксильная группа серина, а не, например, азот имидазола. Наиболее четким доказательством обязательного участия серина является, пожалуй, эксперимент, в котором НО-группа удаляется. Это возможно ввиду того, что атом кислорода серина может быть ацилирован и тем самым превращен в хорошую уходящую группу такими неспецифичными реагентами, как диизопропилфторфосфат ( см. выше) и то-луол-п-сульфонилфторид. Модифицированный таким образом фермент отличается от нативного только отсутствием гидроксильной группы серина; он, например, совершенно нормально связывает субстрат. Однако он полностью неактивен, что согласуется с важнейшей ролью отсутствующей гидроксигруппы в ферментативном катализе. [12]
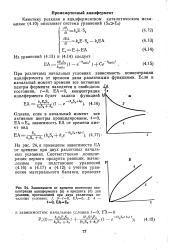 |
Зависимости от времени изменения концентрации ацилфермента ( а и продукта ( б для реакции, протекающей при двух различных начальных условиях. /, 3 - 10, EA 0. 2, 4. [13] |
При различных начальных условиях зависимость концентрации ацилфермента от времени дана различными функциями. [14]
ES - комплекс Михаэлиса, ЕА - ацилфермент, S - суб-стра. [15]
Страницы: 1 2 3 4